bonjour
j'ai des problèmes a assimuler quelques notions en nucléaire
merci beaucoup de m'aider
c'est quoi les spectres d'emission??
SPECTRes d'absorption??
ET CES niveaux d'energie ,(hydrogene par example)
ils veulent signifer quoi?? l'energie de l'atome, du noyau??????............
ET AUSSI jai pas compris l'utilité de E0?
merci beaucoup de m'aider
c'est vraiment tres important
merci encore
Nucléaire
13 messages
- Page 1 sur 1
Salut,
Un spectre d'absorption c'est le spectre obtenu par le passage d'une onde électromagnétique, de la lumière en particulier, au travers d'un milieu transparent ou semi-transparent, dans lequel l'absorption affaiblit (voire élimine) les contributions de certaines fréquences, ce qui donne des raies caractéristiques.
Le spectre d'émission c'est une courbe caractéristique du rayonnement émis par une source, représentant la contribution des différentes radiations le composant en fonction de leur longueur d'onde.
L'atome est électriquement neutre et toute son énergie est concentrée dans son noyau. Les protons (particules positifs) sont situées dans le noyau et ce noyau est entourée d'un champs magnétique où se trouvent des particules appelées neutons (négatifs)
Voilà si d'autres questions je suis là :++:
Bonne continuation
Un spectre d'absorption c'est le spectre obtenu par le passage d'une onde électromagnétique, de la lumière en particulier, au travers d'un milieu transparent ou semi-transparent, dans lequel l'absorption affaiblit (voire élimine) les contributions de certaines fréquences, ce qui donne des raies caractéristiques.
Le spectre d'émission c'est une courbe caractéristique du rayonnement émis par une source, représentant la contribution des différentes radiations le composant en fonction de leur longueur d'onde.
L'atome est électriquement neutre et toute son énergie est concentrée dans son noyau. Les protons (particules positifs) sont situées dans le noyau et ce noyau est entourée d'un champs magnétique où se trouvent des particules appelées neutons (négatifs)
Voilà si d'autres questions je suis là :++:
Bonne continuation
re
mais a propos des niveaux denergie
il s'agit de quoi
ce dont je suis sure c'est qu'ils n'ont rien a avoir avec spectres d'absorption
merci
il s'agit de quoi
ce dont je suis sure c'est qu'ils n'ont rien a avoir avec spectres d'absorption
merci
re
mais a propos des niveaux denergie
il s'agit de quoi
ce dont je suis sure c'est qu'ils n'ont rien a avoir avec spectres d'absorption
car ce sont les niveaux où "sautent" les electrons comme une platforme donc ils ne doivent pas avoir d'energie ,ni doivent avoir une energie negative.
ce que j'ai compris moi c'est que les electrons sont tres pres du noyau de l'atome ,et chaque fois qu'il "sautent" ces niveaux d'energie c'est qu'ils s'eloignent du noyau. Donc klorsqu'ils arrivent au niveau" infini" c'est qu'ils sont tres tres loin du noyau.
merci mille fois de repondre a mes interrogations, et de dissiper mes lacunes.
a bientot
il s'agit de quoi
ce dont je suis sure c'est qu'ils n'ont rien a avoir avec spectres d'absorption
car ce sont les niveaux où "sautent" les electrons comme une platforme donc ils ne doivent pas avoir d'energie ,ni doivent avoir une energie negative.
ce que j'ai compris moi c'est que les electrons sont tres pres du noyau de l'atome ,et chaque fois qu'il "sautent" ces niveaux d'energie c'est qu'ils s'eloignent du noyau. Donc klorsqu'ils arrivent au niveau" infini" c'est qu'ils sont tres tres loin du noyau.
merci mille fois de repondre a mes interrogations, et de dissiper mes lacunes.
a bientot
Bonjour Khaoua2,
D'abord pour clarifier les choses, les électrons sont liés à l'atome et donc ne sont pas libres et ont par conséquent une énergie totale négative.
Pour expliquer les niveaux d'énergie, ce n'est pas très compliqué tu vas voir. Imaginons l'atome d'hydrogène, le plus simple puisqu'il n'a qu'un seul électron. Plus cet électron est proche du noyau, plus petite est son énergie totale (à cause de l'attraction de Coulomb), donc il a besoin de recevoir de l'énergie pour s'éloigner du noyau. Inversément, s'il s'approche du noyau, de l'énergie va être émise.
Jusque là, pas très compliqué... ou ça se corse, c'est que la mécanique quantique implique que l'électron ne peut pas être à n'importe quelle distance du noyau, il ne peut pas s'approcher et s'éloigner de manière continue. Si tu veux, il y a des distances permises, et d'autres interdites. Chaque distance permise forme ce qu'on appelle un niveau d'énergie. Par conséquent, l'électron, s'il recoit de l'énergie, ne vas pas s'éloigner de manière continue du noyau, mais va sauter d'un niveau à l'autre. Chaque niveau a une énergie bien définie.
Pour sauter vers un niveau supérieur, l'électron a besoin d'énergie, pour aller vers un niveau inférieur, il en émet. Le niveau d'énergie le plus bas s'appelle l'état fondamental.
J'espère t'avoir aidé un peu... bonne journée!
Julien.
ps: si tu veux plus d'infos ou discuter plus en détails... mon adresse msn est sur mon profil, tu es le ou la bienvenu(e)
D'abord pour clarifier les choses, les électrons sont liés à l'atome et donc ne sont pas libres et ont par conséquent une énergie totale négative.
Pour expliquer les niveaux d'énergie, ce n'est pas très compliqué tu vas voir. Imaginons l'atome d'hydrogène, le plus simple puisqu'il n'a qu'un seul électron. Plus cet électron est proche du noyau, plus petite est son énergie totale (à cause de l'attraction de Coulomb), donc il a besoin de recevoir de l'énergie pour s'éloigner du noyau. Inversément, s'il s'approche du noyau, de l'énergie va être émise.
Jusque là, pas très compliqué... ou ça se corse, c'est que la mécanique quantique implique que l'électron ne peut pas être à n'importe quelle distance du noyau, il ne peut pas s'approcher et s'éloigner de manière continue. Si tu veux, il y a des distances permises, et d'autres interdites. Chaque distance permise forme ce qu'on appelle un niveau d'énergie. Par conséquent, l'électron, s'il recoit de l'énergie, ne vas pas s'éloigner de manière continue du noyau, mais va sauter d'un niveau à l'autre. Chaque niveau a une énergie bien définie.
Pour sauter vers un niveau supérieur, l'électron a besoin d'énergie, pour aller vers un niveau inférieur, il en émet. Le niveau d'énergie le plus bas s'appelle l'état fondamental.
J'espère t'avoir aidé un peu... bonne journée!
Julien.
ps: si tu veux plus d'infos ou discuter plus en détails... mon adresse msn est sur mon profil, tu es le ou la bienvenu(e)
re
bonjour
je me demandais si l'ionisation signifiait le deplacement du niveau n=1 jusquau niveau infini
ou bien il signifait le deplacement du niveau n=1 jusqua n=90 ou n =91........
je voulais tout simplement savoir cest quoi la definition exacte de l'ionisation
j'ai trouvé cela dans beaucoup d'exercices (hydrogene surtout)
merci encore
je me demandais si l'ionisation signifiait le deplacement du niveau n=1 jusquau niveau infini
ou bien il signifait le deplacement du niveau n=1 jusqua n=90 ou n =91........
je voulais tout simplement savoir cest quoi la definition exacte de l'ionisation
j'ai trouvé cela dans beaucoup d'exercices (hydrogene surtout)
merci encore
re
jai trouvé ce probleme dans cette question
on donne a latome dhydrogene une energir de E=14.6 ev
sachant quelle est dans le niveau n=1
esce quelle s'ionise??
merci
on donne a latome dhydrogene une energir de E=14.6 ev
sachant quelle est dans le niveau n=1
esce quelle s'ionise??
merci
re
"on donne a latome une energie E=14.6 ev
cette energie s'agit de En ou Ep ou l'energie d'absorption" je dont je suis sur c'est quil ne s'agit pas de E1 , car dans lenoncé ils ont bien dit que latome etait bel et bien dans le niveau n=1
merci
cette energie s'agit de En ou Ep ou l'energie d'absorption" je dont je suis sur c'est quil ne s'agit pas de E1 , car dans lenoncé ils ont bien dit que latome etait bel et bien dans le niveau n=1
merci
NON, c'est 13.6 eV, c'est une faute de frappe de ton bouquin, tout le monde ici te dira comme moi!
Les energies que je t'ai données

sont des énergies totales (terme cinétique positif+terme potentiel négatif dû à l'attration de Coulomb qui l'emporte sur le signe et donc qui rend l'énergie totale négative ce qui implique que l'électron n'est pas libre) pour l'atome d'hydrogène (on retrouve la même chose qu'on utilise le modèle semi-classique de Bohr ou la théorie quantique).
Donc pour reprendre ton problème, considérons l'atome d'hydrogène dans l'état fondamental n=1. Selon la relation ci-dessus, l'électron a donc une énergie TOTALE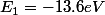 . Donc si on lui apporte 13.6eV, il a au final une énergie totale nulle et par conséquent se trouve libre de sortir de l'atome. L'atome est donc ionisé dans ce cas puisque l'électron s'est fait la malle. (Tu remarqueras que
. Donc si on lui apporte 13.6eV, il a au final une énergie totale nulle et par conséquent se trouve libre de sortir de l'atome. L'atome est donc ionisé dans ce cas puisque l'électron s'est fait la malle. (Tu remarqueras que  .)
.)
Est-ce que je réponds?
Bon dimanche!
Les energies que je t'ai données
sont des énergies totales (terme cinétique positif+terme potentiel négatif dû à l'attration de Coulomb qui l'emporte sur le signe et donc qui rend l'énergie totale négative ce qui implique que l'électron n'est pas libre) pour l'atome d'hydrogène (on retrouve la même chose qu'on utilise le modèle semi-classique de Bohr ou la théorie quantique).
Donc pour reprendre ton problème, considérons l'atome d'hydrogène dans l'état fondamental n=1. Selon la relation ci-dessus, l'électron a donc une énergie TOTALE
Est-ce que je réponds?
Bon dimanche!
13 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 20 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
