Le Lugol est une solution antiseptique. Il s'agit, pour simplifier, d'une solution de diiode dans l'eau. Dans le but de déterminer la concentration molaire du diiode dans le Lugol, on propose le mode opératoire suivant :
Manipulation 1 : on prépare une échelle de teintes à partir d'une solution-mère de diiode pour laquelle la concentration molaire en diiode est
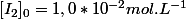
.
Pour cela, on prépare 10,0mL de quelques solutions diluées :
on verse dans une fiole jaugée de 10,0mL, les volumes V de solution-mère indiqués dans le tableau ci-dessous et on complète au trait de jauge avec de l'eau distillée. On verse 5mL de chaque solution dans un tube à essais.
(S = Solution n°) en mL
[I2] en mol.L-1
V(S1) : 1,0 V(S2) : 2,0 V(S3) : 4,0 V(S4) : 5,0 V(S5) : 6,0 V(S6) : 8,0
[I2](S1) : ? [I2](S2) : ? [I2](S3) : ? [I2](S4) : ? [I2](S5) : ? [I2](S6) : ?
Manipulation 2 : la solution commerciale de Lugol est diluée 10 fois pour obtenir 100,0mL de solution diluée. On verse 5mL de la solution diluée dans un tube à essays identique aux précédents.
Par comparaison, on constate que la teinte de la solution de Lugol diluée est voisine de celle de la solution n°3.
a) Compléter la dernière ligne du tableau ci dessus
b) Décrire précisément le mode opératoire suivi pour diluer le Lugol. On pourra s'aider de shémas.
c) Trouver la concentration molaire du diiode dans le Lugol.
 pour obtenir
pour obtenir  en
en  ?
?