Chaleur dégagée d'une réaction
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
jonses
- Membre Relatif
- Messages: 496
- Enregistré le: 19 Mai 2013, 09:33
-
 par jonses » 14 Juin 2021, 07:21
par jonses » 14 Juin 2021, 07:21
Bonjour à tous,
La chimie n'est pas mon fort, et mes quelques cours de chimie que j'ai perdus remontent à très loin. Du coup j'aurai bien besoin d'aide pour la question suivante svp :
On considère la réaction suivante
})
à pression et température constantes, la chaleur dégagée
})
par cette réaction vaut :
} = 57,8 kcal) Que vaut la chaleur dégagée
Que vaut la chaleur dégagée }) à masse volumique et température constantes de la réaction suivante :
à masse volumique et température constantes de la réaction suivante : } + 5N_2)
Je vous remercie d'avance pour votre aide
-
phyelec
- Habitué(e)
- Messages: 988
- Enregistré le: 06 Mar 2020, 16:47
-
 par phyelec » 14 Juin 2021, 22:04
par phyelec » 14 Juin 2021, 22:04
Bonjour,
vous avez:

soit :
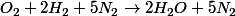
soit :
 +5 N_2\rightarrow 2H_2O + 5N_2)
le terme
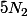
ne bouge pas donc ne dégage aucune énergie
reste le terme
 \rightarrow 2H_2O)
je dirai donc 2 * 57,8kcal
-
jonses
- Membre Relatif
- Messages: 496
- Enregistré le: 19 Mai 2013, 09:33
-
 par jonses » 15 Juin 2021, 12:38
par jonses » 15 Juin 2021, 12:38
phyelec a écrit:Bonjour,
vous avez:

soit :
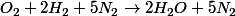
soit :
 +5 N_2\rightarrow 2H_2O + 5N_2)
le terme
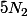
ne bouge pas donc ne dégage aucune énergie
reste le terme
 \rightarrow 2H_2O)
je dirai donc 2 * 57,8kcal
Merci pour la réponse.
Mais est-ce normal que je ne vois pas intervenir de considération sur la masse volumique, la température et la pression ?
Dans la question, on insiste sur le fait que ces 57,8 kcal correspondent à la réaction à pression et température constantes, et que l'on cherche la chaleur dégagée pour la réaction à masse volumique et température constantes.
Est-ce que ces indications <<réaction à
)
constantes>> et <<réaction à
 constantes)
>> sont trompeuses ?
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 1 invité
