Bonjour à tous :
J'ai quelques questions à vous poser concernant la solution d'un exo que je comprends pas :
Exercice :On prépare une solution

de

en dissolvant

du gaz "Amoniac" dans un litre d'eau pure et on donne comme valeur du volume molaire :
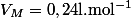
et

.
 $)
Calculer la concentration molaire

de

 $)
Citer quelles sont les espèces chimiques se trouvant dans la solution

et calculer leurs concentrations
 $)
Etablir que l'Amoniac" est une base faible
 $)
Ecrire la réaction chimique de decomposition de l'Amoniac dans l'eau.
 $)
Donner l'expression de la constante d'acidité :

et calculer sa valeur.
Pour s'assurer experimentalement de l'exactitude de la concentration molaire

de la solution

, on melange

de la solution

, avec une solution aqeuse

de

de concentration :

. On obtient le point d'équivalence en ajoutant :

de la solution

au volume

de la solution

.
 $)
Calculer :

 $)
Si

au point d'équivalence est egale à

, Calculer la concentration des espèces chimiques presentes dans le melange à l'équivalence.
Solution : $)
}{V_{S }} = \frac{V}{V_{M}.V_{S}} = 10^{-2} \mathrm{mol.l}^{-1} $)
 $)
Les espèces chimiques qui se trouvent dans la solution sont :

,

,

,

et

.
On a :



On applique la neutralité éléctrique à la solution et on considère que :



On applique la conservation de la masse :



 $)
On remarque que :

, celà veut dire que la dissociation de

dans l'eau est très faible, et le coefficient de disociation est :

. Par conséquent : l'Amoniac est une base faible.
 $)


Puisque :

, on trouve :

 $)
Au point d'équivalence :

, c'est à dire :

Les espèces chimiques presentes dans le melange sont :

,

,

,

,

et

A l'equivalence :

:



D'apès la neutralité electrique :

D'après la conservtion de la masse :
}{V_{1}+V_{2}} = [NH_{3}] + [NH_{4}^{+}] $)
 Question :
Question :Alors ce que je comprends pas, est la methode de calculer :

Je comprends pas d'où viennent ces expressions ( en detail si celà ne vous derange pas bien sûr ) :

}{V_{1}+V_{2}} = [NH_{3}] + [NH_{4}^{+}] $)
et

Merci d'avance de votre aide !
