Entropie
De la mécanique au nucléaire, nos physiciens sont à l'écoute
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 17:22
par barbu23 » 20 Mar 2010, 17:22
Bonjour, :happy3:
Je cherche un exemple simple qui met en application, ce qui se dit dans le texte suivant :
Il existe une fonction détat, notée :

et appelée entropie, qui obéit à un principe dextremum.
Pour un système isolé :
lentropie est maximale à léquilibre thermodynamique.
lentropie augmente :
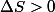
au cours dune évolution irréversible.
lentropie reste constante :
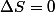
si la transformation est réversible.
Pourquoi, lentropie est maximale à léquilibre thermodynamique ?
Merci d'avance ! :happy3:
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 17:29
par barbu23 » 20 Mar 2010, 17:29
lentropie dun système isolé ( le degré de desordre , de turbulance ) ne peut pas diminuer, elle augmente ou elle reste constante si la transformation est réversible.
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 12:00
-
 par anima » 20 Mar 2010, 17:34
par anima » 20 Mar 2010, 17:34
barbu23 a écrit:Bonjour, :happy3:
Je cherche un exemple simple qui met en application, ce qui se dit dans le texte suivant :
Pourquoi, lentropie est maximale à léquilibre thermodynamique ?
Merci d'avance ! :happy3:
Un équilibre thermodynamique est irréversible (i.e. il est impossible de "briser" l'équilibre sans apport d'énergie). Donc, par définition,
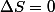
en cas d'équilibre.
Toute action en dehors d'un équilibre doit, pour satisfaire cette définition, augmenter l'entropie du systeme. Autrement, comment serait-il possible d'avoir un cas ou
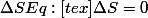
), et est la meilleure solution pour un systeme (pour toute position P différent d'Eq, Eq->p:
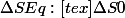
).
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 18:06
par barbu23 » 20 Mar 2010, 18:06
c'est quoi un équilibre thermodynamique ? :hein:
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 12:00
-
 par anima » 20 Mar 2010, 18:10
par anima » 20 Mar 2010, 18:10
barbu23 a écrit:c'est quoi un équilibre thermodynamique ? :hein:
Tu poses une question sans meme te préoccuper des définitions présentes dans cet énoncé?
Equilibre thermodynamique = Equilibre thermal (dT = 0) + Equilibre mecanique (dE = 0) + equilibre chimique (eta = 0).
-
Mathusalem
- Membre Irrationnel
- Messages: 1837
- Enregistré le: 14 Sep 2008, 04:41
-
 par Mathusalem » 20 Mar 2010, 18:11
par Mathusalem » 20 Mar 2010, 18:11
Je te l'ai écrit dans un autre Post. Le problème avec ce genre de question Barbu, c'est qu'on a l'impression de se faire prendre pour des pigeons :)... Qu'est-ce que ça peut bien vouloir dire à ton avis ? Equilibre statique, ça bouge pas. Equilibre d'inertie (j'sais plus comment) ça ne tourne pas... Equilibre thermodynamique (entre deux objets ) il n'y a pas d'.... de ..... donc ils sont à même .....
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 18:19
par barbu23 » 20 Mar 2010, 18:19
Parfait ! c'est pour bien comprendre pour que ça pose pas de problèmes après ! :happy3:
Donc :
Equilibre thermodynamique = (
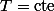
: (

et

peuvent varier ) + (
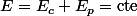
ou bien :
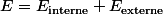
? ) + ( Equilibre chimique (
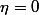
) je sais pas ce que c'est ) ! :happy3:
C'est quoi un equilibre chimique ? :happy3:
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 18:27
par barbu23 » 20 Mar 2010, 18:27
je ne suis pas physicien de formation, ni chimiste ! :hum:
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 18:50
par barbu23 » 20 Mar 2010, 18:50
c'est reglé pour l'energie mecanique :

avec

: energie interne ! :happy3:
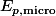
: energie potentielle derivant de forces d'interaction microscopiques entre les particules du système !
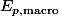
: energie potentielle derivant de forces externes au système comme le poids !
reste maintenant à definir ce qu'est l'equilibre chimique ( je ne fais pas de chim ie depuis le lycée ) :happy3:
-
Mathusalem
- Membre Irrationnel
- Messages: 1837
- Enregistré le: 14 Sep 2008, 04:41
-
 par Mathusalem » 20 Mar 2010, 18:54
par Mathusalem » 20 Mar 2010, 18:54
En deux mots, car tu pousses un peu le bouchon : Deux objets réagissent-ils ensemble ? Oui : pas encore d'equilibre chimique| Non : equilibre chimique atteint.
Une reaction chimique libère ou bouffe de l'energie de son environnement (exotherme pour l'un, endotherme pour l'autre, et me demande pas ce que ca veut dire). Donc qui dit variation d'energie, dit equilibre thermodynamique non atteint.
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 19:02
par barbu23 » 20 Mar 2010, 19:02
Mathusalem a écrit:En deux mots, car tu pousses un peu le bouchon : Deux objets réagissent-ils ensemble ? Oui : pas encore d'equilibre chimique| Non : equilibre chimique atteint.
Une reaction chimique libère ou bouffe de l'energie de son environnement (exotherme pour l'un, endotherme pour l'autre, et me demande pas ce que ca veut dire). Donc qui dit variation d'energie, dit equilibre thermodynamique non atteint.
l'equilibre chimique est realisée quant il n'y'a pas de transfert d'energie tout court ! :happy3:
-
Mathusalem
- Membre Irrationnel
- Messages: 1837
- Enregistré le: 14 Sep 2008, 04:41
-
 par Mathusalem » 20 Mar 2010, 19:03
par Mathusalem » 20 Mar 2010, 19:03
Oui mais tu verras que ma réponse n'est de loin pas la plus formelle, comme tu peux le lire sur le lien wikipédia proposé.
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 19:16
par barbu23 » 20 Mar 2010, 19:16
Vous trouvez pas qu'il y'a un petit paradoxe dans ce texte :
Il existe une fonction détat, notée :

et appelée entropie, qui obéit à un principe dextremum.
Pour un système isolé :
lentropie est maximale à léquilibre thermodynamique.
lentropie augmente :
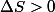
au cours dune évolution irréversible.
lentropie reste constante :
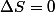
si la transformation est réversible.
Parceque , d'un coté, il est dit que, l'entropie est
maximale à l'équilibre thermodynamique, c'est à dire il ne peut aller plus que cette valeur maximale ( il peut pas aumenter ) . Par contre il est dit aussi que l'entropie augmente au cours d'une transformation irréversible :
impossible
à mon avis car, l'entropie ne peut pas augmenter plus que cette valeur maximale puisqu'il l'a atteint dèjà cette valeur maximale à l'equilibre.
si c'est correct ce qu'on dit là, ça veut dire que l'entropie est une fonction decroissante, et que l'entropie diminue au cours d'une transformation en passant de l'equilibre au désequilibre ( là où il y'a plus d'agitation au niveau des particules ) ... ! :happy3:
Est ce que c'est vrai ça ? :hein:
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 12:00
-
 par anima » 20 Mar 2010, 19:18
par anima » 20 Mar 2010, 19:18
barbu23 a écrit:Vous trouvez pas qu'il y'a un petit paradoxe dans ce texte :
Parceque , d'un coté, il est dit que, l'entropie est maximale à l'équilibre thermodynamique, c'est à dire il ne peut aller plus que cette valeur maximale ( il peut pas aumenter ) . Par contre il est dit aussi que l'entropie augmente au cours d'une transformation irréversible :
impossible à mon avis car, l'entropie ne peut pas augmenter plus puisqu'il a atteint dèjà une valeur maximale à l'equilibre.
si c'est correct ce qu'on dit là, ça veut dire que l'entropie est une fonction decroissante, et que l'entropie diminue au cours d'une transformation en passant de l'equilibre au désequilibre ( là où il y'a plus d'agitation au niveau des particules ) ... ! :happy3:
Est ce que c'est vrai ça ? :hein:
Et...depuis quand un passage d'équilibre a déséquilibre se fait sans apport d'énergie au systeme?
La définition reste correcte.
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 19:31
par barbu23 » 20 Mar 2010, 19:31
Oui, je comprends ce que tu veux dire là ! :happy3: c'est comme dans un verre d'eau un peu froid par exemple, et on met une petite cuillère dedans, et on commence à l'agiter sans arret, et là, l'eau devient de plus en plus chaud qu'avant ! ce qui confirme qu'il y'a un apport d'energie au système ! :happy3:
Mais, moi ce que je dis, c'est qu'on aurait mieux fait de supprimer ce mot : maximal de ce texte, car ça n'a pas de sens ! maximale, c'est pour dire quoi exactement ? :happy3:
Les auteurs aurait mieux ecrit : minimale au lieu de maximal, car l'entropie ne diminue jamais, et ne va que dans un sens croissant ! :happy3:
Merci en tous cas ! :happy3:
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 19:43
par barbu23 » 20 Mar 2010, 19:43
anima a écrit:Un équilibre thermodynamique est irréversible (i.e. il est impossible de "briser" l'équilibre sans apport d'énergie). Donc, par définition, en cas d'équilibre.
la reponse est là ! j'ai pas vu ! :hum:
Merci ! :happy3:
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 19:47
par barbu23 » 20 Mar 2010, 19:47
Que faut -t-il retenir principalement de ce deuxième principe de thermodynamique ? :happy3:
que dans une transformation reversible :

! c'est tout ? :happy3:
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 12:00
-
 par anima » 20 Mar 2010, 20:03
par anima » 20 Mar 2010, 20:03
barbu23 a écrit:Que faut -t-il retenir principalement de ce deuxième principe de thermodynamique ? :happy3:
que dans une transformation reversible :

! c'est tout ? :happy3:
Dans toute transformation,
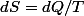
. Et dans tous les cas,
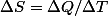
.
En gros, le 2e principe est en lui-meme presque inutile. Cependant, tu peux "combiner" la 2e et 1ere loi afin d'obtenir le principe de Carnot, qui est (tres) utile.
-
barbu23
- Membre Transcendant
- Messages: 5466
- Enregistré le: 18 Fév 2007, 18:04
-
 par barbu23 » 20 Mar 2010, 20:14
par barbu23 » 20 Mar 2010, 20:14
Mathusalem a écrit:... car tu pousses un peu le bouchon ...
.
:ptdr:
J'adore cette expression ! :happy3:
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 12 invités
et appelée entropie, qui obéit à un principe dextremum.
au cours dune évolution irréversible.
si la transformation est réversible.
