Formule du paracétamol
Le paracétamol, principe actif de médicament tel que le Doliprane, ou l'Efferalgan, a pour formule brute CxHyOzN.
Le paracétamol contient en masse :
56,7% de carbone, 7,1% d'hydrogène, et 25,2% d'oxygène.
1)Déterminer le pourcentage en masse d'azote dans le paracétamol.
2) A partir de la formule brute donnée ci-dessus, déterminer la masse molaire du parcétamol.
3) Déterminer les valeurs de x, y et z.
merci de votre aide. :we:
Aide en chimie... pas en maths
6 messages
- Page 1 sur 1
ce que j'ai trouvé...
1) Pour le pourcentage en azote, j'ai fait comme calcul:
%Mz= 100 - (56,7+7,1+25,2)
= 100 - 89
= 11
Le pourcentage en azote est donc de 11%
2) Je suis pas sur alors j'attend de l'aide.
%Mz= 100 - (56,7+7,1+25,2)
= 100 - 89
= 11
Le pourcentage en azote est donc de 11%
2) Je suis pas sur alors j'attend de l'aide.
Ma proposition
2) Masse molaire:
M= 12X x 56,7/100 + 1Y x 7,1/100 + 16Z x 25,2/100
M= 6,8x + 7,1 x10-2y + 4,032z
Mais je vois pas comment continuer,
Je croit que je n'ai pas tout compris à la question !
M= 12X x 56,7/100 + 1Y x 7,1/100 + 16Z x 25,2/100
M= 6,8x + 7,1 x10-2y + 4,032z
Mais je vois pas comment continuer,
Je croit que je n'ai pas tout compris à la question !
Pour une fois je vais faire le calcul complet. Car on voit assez rarement le calcul mené de bout en bout, comme je vais le développer ici. En général on prie l'élève de "sentir" la dernière étape. Allons-y !
Tu disposes d'une substance X contenant 56.7% C, 7.1% H, 25.2% O, et 11% N.
Cette substance X a un poids moléculaire M, qui est encore inconnu.
Mais 100 g de ta substance contient
56,7 g C, donc 56.7/12 = 4.725 mole de C
7.1 g H, donc : 7.1 mole H
25.2 g O, donc : 25.2/16 = 1.575 mole O
11 g N, donc : 11/14 = 0.7857 mole N
Partons du chiffre le plus petit, 0.785 mole N. Combien faudrait-il de gramme de X pour avoir 1 mole de N ? Réponse : 100/0.7857 = 127.
Dans 127 gramme de X il y a 1 mole de N. Combien y a-t-il de moles C, H et O ? On recommence les calculs.
Dans 127 g de X, il y a :
- 127 · 0.567 = 72.00 g C, donc 72/12 = 6.00 moles C
- 127 · 0.071 = 9.01 g H, donc 9.01/1.008 = 9.00 moles H
- 127 · 0.252 = 32.00 g O, donc 32.00/16 = 2.00 moles O
Ta substance est donc :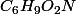
Tu disposes d'une substance X contenant 56.7% C, 7.1% H, 25.2% O, et 11% N.
Cette substance X a un poids moléculaire M, qui est encore inconnu.
Mais 100 g de ta substance contient
56,7 g C, donc 56.7/12 = 4.725 mole de C
7.1 g H, donc : 7.1 mole H
25.2 g O, donc : 25.2/16 = 1.575 mole O
11 g N, donc : 11/14 = 0.7857 mole N
Partons du chiffre le plus petit, 0.785 mole N. Combien faudrait-il de gramme de X pour avoir 1 mole de N ? Réponse : 100/0.7857 = 127.
Dans 127 gramme de X il y a 1 mole de N. Combien y a-t-il de moles C, H et O ? On recommence les calculs.
Dans 127 g de X, il y a :
- 127 · 0.567 = 72.00 g C, donc 72/12 = 6.00 moles C
- 127 · 0.071 = 9.01 g H, donc 9.01/1.008 = 9.00 moles H
- 127 · 0.252 = 32.00 g O, donc 32.00/16 = 2.00 moles O
Ta substance est donc :
Merci !!!!
Je viens de comprendre l'exercice !!! :we:
Je pensais pas faire comme ça,
Merci de m'avoir expliquer.
Voilà, exercice de chimie fini, place à la physique.
:ptdr:
Je pensais pas faire comme ça,
Merci de m'avoir expliquer.
Voilà, exercice de chimie fini, place à la physique.
:ptdr:
6 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 3 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
