Bon, puisque apparemment ça n'intéresse plus personne, je donne la réponse pour ceux que ça intéresse.
Séparons l'aspect macroscopique et microscopique.
Macroscopiquement, soit une mole de gaz. On se rend compte qu'à température fixée, et quelque soit la nature de gaz,
\,=A$)
, constante identique pour tous les gaz, et fonction de la température seule. Pour le gaz parfait, PV=A pour toute pression P. L'expérience montre que sur [0;2bar], l'écart relatif

entre le gaz parfait et le gaz réel est de l'ordre ou inférieur à 1%. Pour un gaz réel, au fur et à mesure que la pression augmente, le produit PV diminue ou augmente à partir de cette valeur A.
Nous venons de voir que cette constante A ne dépend que de la température. D'où l'idée qu'ont eue les physiciens de se servir de cette constante comme une grandeur thermométrique. Elle est à la base du thermomètre à gaz. Par définition, toujours en prenant une mole de gaz, la température légale est définie par la relation
_{temperature = cte}$)
, où R est la constante des gaz parfait.
Microscopiquement maintenant. Un gaz parfait est constitué de
molécules ponctuelles sans intéractions entre elles. Ce sont les 2 points simplificateur d'un gaz parfait. Le gaz réel se comporte différemment : les molécules ont un volume propre (le covolume) et il y a des interactions attractives entre molécules dans l'état gazeux (forces de Van der Walls). On voit ici le pourquoi du résultat macroscopique : quand la pression augmente, c'est que les molécules sont de plus en plus proches les unes des autres, et ainsi, les forces de Van der Walls gagne en importance et la place qu'occupe les molécules ne peut plus être ignorée.
Pour décrire le gaz, on utilise alors l'équation d'état de Van der Walls, qui prend en compte la double correction du volume propre des molécules et d'intéractions attractives entre molécules.
Pour une mole de molécules,
(V-b)=R\,T$)
, où a et b sont deux constantes caractéristiques de la nature du gaz, et R la constante de gaz parfait.
b est donc le covolume : caractérise le volume propre d'une mole de molécules quand elles sont en contact :
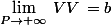
.
a/V² est la correction apportée du fait des forces d'intéractions de Van der Walls.
Finalement, pour tous gaz réels, quand P tend vers 0, on retrouve le comportement limite de gaz parfait puisque plus d'intéractions, et le volume des molécules n'a plus d'importance : pour une mole,
\,=R\,T$)
mathématique c'est le
en physique.
