Variation d'énergie
De la mécanique au nucléaire, nos physiciens sont à l'écoute
-
MacErmite
- Membre Relatif
- Messages: 408
- Enregistré le: 12 Mai 2006, 12:00
-
 par MacErmite » 18 Déc 2006, 01:06
par MacErmite » 18 Déc 2006, 01:06
Bonsoir,
Je suis devant un problème de thermodynamique. Le processus est irreversible, de pression interne constante. Le volume interne et la température interne varie. Le tout est adiabatique
Alors j'ai utilisé cette relation : H = U + Pv après
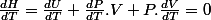
Avec
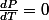
puisque la pression est constante, après développement des autres termes je cherche à exprimer la température finale.
Détails :
dH = dW + dQ + P.dV (avec P pression interne),
dW = -Pextérieur.dV,
dQ = C(p,m).(n).dT,
C'est une compression donc elle devrait augmenter mais ce n'est pas le cas. Le point de départ est-il faut ?
-
flaja
- Membre Rationnel
- Messages: 904
- Enregistré le: 02 Juil 2006, 16:24
-
 par flaja » 18 Déc 2006, 22:24
par flaja » 18 Déc 2006, 22:24
bonsoir,
le problème est incohérent.
on aurait une pression initiale interne P < Pext qui resterait constante pendant le processus ?
=> le piston devrait comprimer l'air et augmenter sa température et sa pression.
On ne peut pas chauffer non plus puisque c'est adiabatique.
???
-
MacErmite
- Membre Relatif
- Messages: 408
- Enregistré le: 12 Mai 2006, 12:00
-
 par MacErmite » 19 Déc 2006, 14:55
par MacErmite » 19 Déc 2006, 14:55
flaja a écrit:bonsoir,
le problème est incohérent.
on aurait une pression initiale interne P le piston devrait comprimer l'air et augmenter sa température et sa pression.
On ne peut pas chauffer non plus puisque c'est adiabatique.
???
l'interet est surtout d'argumenter le processus afin de poser correctement les différentes expressions permettant de calculer la température à l'intérieur du piston par exemple ....
Cela oublige parfois à connaître les démonstrations des formules simplifiées dans un contexte particulier.
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités
