Imagine un cylindre dans lequel est enfermé un gaz. Le couvercle de ce cylindre est un piston que tu peux bouger, de manière à comprimer le gaz.
Si tu pousses le piston, tu es entrain de comprimer le gaz : En le comprimant, tu le chauffes, donc son energie interne augmente. Ceci se traduit par W>0.
Si, au contraire, tu dilates le gaz, c'est à dire qu'au lieu de pousser le piston, tu le tires vers toi, alors tu laisses le gaz occuper plus de place. Donc, il se dilate, donc il refroidit. Son energie interne diminue. Ceci se traduit par W<0.
Ce W, c'est le travail Du PISTON sur LE GAZ.
Si tu veux le travail du GAZ sur le PISTON, tu inverses les signes, c'est exactement le contraire.
Quand tu changes l'energie interne par le seul travail W, sans echange de chaleur Q, tu qualifies ce procédé de Procédé Adiabatique.
-------
Si tu te demandes pourquoi est-ce que quand tu comprimes un gaz, il chauffe, voici la réponse :
Les gaz, dans le cas idéal, obéissent à cette loi ci :
PV = nRT
où P est la pression, V le volume, n le nombre de moles, R une constante et T la température.
Or, qu'est-ce que la pression dans ce cas précis ? C'est la Force appliquée par le pistion divisée par l'aire du piston.
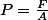
.
En sachant cela, quand tu comprimes un gaz, la température augmente. Cela veut dire que P augmente plus vite que V diminue quand tu comprimes un gaz, sinon T ne devrait pas devenir plus grand. C'est bien le cas.
Quand tu comprimes un gaz, tu essaies de rapprocher les molécules les unes des autres. Or, la force de répulsions entre deux atomes obéit une loi en 1/r^2.
C'est à dire que si tu veux diminuer le volume par 2, tu dois augmenter la pression (force) par 4 (en simplifié..)
Donc, quand tu comprimes le gaz, dans PV = nRT, P augmente plus vite que V diminue, donc T doit augmenter. Quand tu le dilates, c'est simplement l'inverse. P diminue plus vite que V augmente, donc T doit diminuer.
----
A+