Fission: quel galère
De la mécanique au nucléaire, nos physiciens sont à l'écoute
 par Dominique Lefebvre » 30 Oct 2006, 18:26
par Dominique Lefebvre » 30 Oct 2006, 18:26
Léina a écrit:
question 1:Calculer l'énergie totale libérée par le fonctionnement du réacteur fossile sachant que la fission d'un noyau 235U libère en moyenne 200MeV.
Voici que j'ai fait:
Il faut caculer le nombre d'atomes 235U dans 2 tonnes et mulitplier par 200 MeV:
m:2 tonnes= 2.10^6kg
je pense qu'il faut utiliser la formule:
E=m.c²
Franchement je n'arrive pas.
Une question: faut-il écrire l'équation? Moi je n'y vois rien.
Merci
Bonsoir,
Ce n'est pas si compliqué! Le MeV est déjà une unité d'énergie...
1 MeV vaut 1,6*10^-13 J
Il te reste à déterminer le nombre d'atomes d'uranium dans 2 tonnes d'uranium et le tour est joué.
Pour ce faire, pense à Avogadro et à la masse molaire de l'uranium...
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 31 Oct 2006, 11:14
par anima » 31 Oct 2006, 11:14
Léina a écrit:Bonjour!
J'ai essayé mais je n'arrive toujours pas!
2 tonnes= 2.10^6 kg
1Mev=1,6.10^-13J
200.10^6 eV*1,6.10^-19J
La constante d'Avogado:
n=(N)/(Na) avec Na=6,02.10^23
et que la masse molaire de U est 235 car 235 U d'après le texte.
La quantité de matière est:
n=m/M
n=N/Na=m/M
n=M/Na=235/6,02.10^23
n=4
C'est bizarre :pi:
Donc l'expression pour répondre à cette question
E=m.c² (mais je n'ai pas c²) :doh:
Aidez-moi svp!!
Merci
La masse molaire de l'uranium 235 n'est pas 235. 235 est son numéro atomique....
-
flaja
- Membre Rationnel
- Messages: 904
- Enregistré le: 02 Juil 2006, 16:24
-
 par flaja » 01 Nov 2006, 10:04
par flaja » 01 Nov 2006, 10:04
bonjour,
1) la masse molaire de l'uranium 235 est voisine de 235g/mole, approximation suffisante pour cet exercice
(l'égalité n'étant rigoureuse que pour le carbone 12 qui sert à la définition du nombre d'Avogadro)
2)
Energie= (m * E * Na)/ M <-------------- OK
2 tonnes= 2.10^6 kg <----------- NON : 1 tonne = 10^3 kg = 10^6 g
Mais ton résultat est bon quand même car tu divises par 235 g = au lieu de 0.235 kg
Remarque :
En mettant les unités comme suit, comme si mole, atome étaient des unités comme les kg ou les J
on voit qu'il faut multiplier Na par n pour avoir un nombre d'atomes
Na = Nombre d'atomes / mole
M = masse / mole
nombre de moles : n = m / M en moles
nombre d'atomes : n * Na
E = énergie / atome
d'où M / Na = masse d'un atome
-
flaja
- Membre Rationnel
- Messages: 904
- Enregistré le: 02 Juil 2006, 16:24
-
 par flaja » 01 Nov 2006, 12:37
par flaja » 01 Nov 2006, 12:37
E totale =N*E libérée avec N=Na*m/M <------------ OK
une période T correspond à la désintégration de la moitié des noyaux : donc
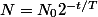
quand t = T :
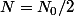
tu écris
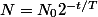
pour chacun des 2 isotopes (ici 1 et 2)
tu connais
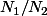
actuel, te temps
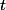
, tu en déduis
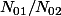
-
flaja
- Membre Rationnel
- Messages: 904
- Enregistré le: 02 Juil 2006, 16:24
-
 par flaja » 01 Nov 2006, 16:14
par flaja » 01 Nov 2006, 16:14
je ne vois pas ce que je peux te dire de plus que :
tu connais
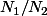
actuel, le temps t
tu en déduis
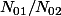
=> exprime
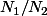
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 10 invités
