bonjour,
on peut regarder la vitesse d'une réaction sous deux angles différents:
tout d'abord, on peut regarder l'apparition du produit. v=(1/coef stoechiométrique)*d([produit])/dt
ou alors, on peut également regarder la disparition d'un des réactifs.
v=-(1/c.s.)*d([réactif])/dt. ici le - vient du fait qu'une vitesse (même de réaction) doit rester positive.
tu as donc plusieurs expressions qui décrivent la même vitesse.
pouik a écrit:De plus quand on tient compte de la dégénérescence de l'ordre on obtient une nouvelle experssion de la vitesse de la réaction, mais comment cela se traduit-il sur la vitesse de disparition de
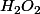
??
en ce qui concerne la dégénérescence de l'ordre, on a effectivement une nouvelle expression de la vitesse, et avec une nouvelle constante de vitesse (k apparent). jsais si g répondu...
