Salut, Max!
J'ai aussi fait de la thermodynamique, mais nous n'avons pas du voir tout à fait les mêmes choses, car je ne sais pas vraiment répondre à tes questions...
Cependant, il me semble que les données que tu as te permettent, avec certaines formules, de déterminer lequel des 2 matériaux est le plus isolant. Ce qui me laisse perplexe, c'est que, d'une part, l'échange de chaleur entre la flamme et l'eau de la casserole doit se faire le mieux possible, donc le fond de la casserole doit être le moins isolant possible. En revanche, il faut qu'il y ait échange du moins de chaleur possible entre la casserole et l'air ambiant. L'idéal serait donc peut-être de faire une casserole dont le fond serait très conducteur, et dont les contours seraient très isolants.
Cependant, l'échange de chaleur est déjà assuré par le fait que l'eau soit en contact avec l'air, donc il semble vain de chercher à empecher cet échange. Je dirais donc qu'il faut choisir le matériau le plus conducteur.
La question 2 me fait penser à ce que je faisais en 1ère, je suis à peu près sûr que l'on avait vu cela, et je me souviens qu'il existe une formule donnant la quantité de chaleur fournie au système en fonction de la quantité d'eau évaporée. Les données sur l'eau sont là à cet effet. Si je me souviens bien, il faut d'abord (
1ère étape )fournir une énergie au système qui va amener l'eau à la bonne température, à la température à laquelle elle va pouvoir s'évaporer, c'est à dire

. La donné à utiliser est ici
.)
Ca tombe bien, c'est une quantité molaire, et par Kelvin, donnée, comme par hasard, à

, donc il te suffit de calculer à combien de moles d'eau correspondent

d'eau, et de combien de degrés tu as du élever la température pour arriver à

. Ensuite (
2ème étape ) une fois que tu es à

, tu dois évaporer

d'eau, et là, la donnée du
)
te permet de savoir la quantité de chaleur à fournir pour vaporiser une mole d'eau se trouvant à

.
Tu vois, je ne savais plus exactement à quoi correspondait chaque symbole, mais ce sont les unités qui m'ont permis de le retrouver. C'est un truc à retenir!
Je dirais donc que la quantité de chaleur à fournir est
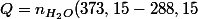 Cp + n_{H_{2}O} \Delta (H_{2}O))
(mais c'est à vérifier).
Je pense que l'approximation qui était à faire était qu'il n'y avait pas d'échange d'énergie entre l'eau de la pièce et l'atmosphère.
Pour les autres questions, je n'ai pas d'idée.
Cependant, je peux te dire qu'il est normal qu'on précise le volume d'un métal à une certaine température. En effet, à ma connaissance, tous les corps sont susceptibles de se dilater, même les métaux.
En espérant t'avoir apporté quelques lumières,
Alpha
PS : n'hésite pas à t'inscrire, ça ne présente aucun inconvénient! :happy3:
