Bonjour à tous...
j'ai un compte rendu de tp de spé phisique chimie à rendre.. et e bloque..
si vous pouvez m'aider..!!
1) on me parle d'eau oxygénée à 20 volumes ce qui signifie que sa dismutation est susceptible de libérer 20 litres de gaz dioxygène par litre de solution d'eau oxygénée.. il me faut écrire la réaction de dismutation du péroxyde d'hydrogène.puis en déduire la concentration molaire de cette eau oxygénée..
l'équation je l'ai trouvée: 2 (H202)=O2 + 2 (H2O)
mon problème c'est que je ne vois pas du tout comment en déduire la concentration molaire...
2) ensuite on parle du "Sel de Mohr et on me dit dessus que c'est des cristaux de (NH4)2 Fe(SO4)2, 6 H2O dissous, contenant des ions Fe(2+) ..
et on me demande la masse molaire du cristal hydraté de sel de Mohr et d'en déduire la masse de cristaux qu'il faut dissoudre pr préparer 100 mL d'une slution de concentration massique 500 mg/L
une fois de plus j'ai trouver la première partie... enfin je suis pas sûre de mon résultat.. je trouve 392 g/mol
mais alors la suite... aucune idée...
3) finalemen... encore une dernière question à laquelle je n'arrive pas à répondre: il faut précisez la verrerie nécessaire et le mode opératoire pour obtenir une solution So de sel de Mohr de concentration 50mg/L à partir de la solution 5 .
les infos de la solution (dans le cadre d'un dosage par étalonnage ) sont: qu'il contient: 1,5 mL de (2H^+ + SO4^(2+)) (com tous les tubes ) puis 1mL de (K^+ +SCN^(-)) (com tous les otre tubes) puis 2,5mL de So (proportion qui augmente ds les different tubes) puis 5,0 mL d'eau distillée (proportion diminuante) et pas de vin blanc (com les 6 premiers tubes) pour un volume total de 10 mL ..
enfin.. sa concentration massique est 12,5mg/L
voilà....
j'espère que vous pourrez m'aider pour la majorité de ces questions..
merci
MArine..
TS.. tp de spécialité phisique chime sur "dosage de l'élément Fer dans le vin blanc"
5 messages
- Page 1 sur 1
Hello,
1) Sert toi du volume molaire Vm = 22.4 L/mol dans les CSTP
2) 500 mg/L de Fe2+ je suppose ?
1 mol de sel de Mohr contient 1 mol de Fe sachant celà il te faut 392 g (j'ai pas vérifié la masse molaire mais bon c'est le ba-ba) de sel de Mohr pour avoir 1 mol de Fe après tu n'as plus qu'à calculer combien 0.5g de Fe représente de mol.
3) Si tu as une sol à 500mg/L pour en avoir à 50 mg/L il faut diluer par 10 !
Après je ne comprends rien au reste de ta question....
Je peux te dire qu'avec les ions et le thiocyanate on a:
Fe3+ + SCN- --> FeSCN2+ de couleur rouge
On mesure ensuite l'intensité de la coloration à l'aide d'un spectrophotomètre
en ayant au préalable effectué une gamme d'étalonnage puisque selon Beer-Lambert A = epsilon x l x C (longueur d'onde = 480 nm)
A absorbance
epsilon : coefficient d'extinction moléculaire mol-1.L.cm-1
l longueur de la cuve en cm
C concentration en mol/L
@+
1) Sert toi du volume molaire Vm = 22.4 L/mol dans les CSTP
2) 500 mg/L de Fe2+ je suppose ?
1 mol de sel de Mohr contient 1 mol de Fe sachant celà il te faut 392 g (j'ai pas vérifié la masse molaire mais bon c'est le ba-ba) de sel de Mohr pour avoir 1 mol de Fe après tu n'as plus qu'à calculer combien 0.5g de Fe représente de mol.
3) Si tu as une sol à 500mg/L pour en avoir à 50 mg/L il faut diluer par 10 !
Après je ne comprends rien au reste de ta question....
Je peux te dire qu'avec les ions et le thiocyanate on a:
Fe3+ + SCN- --> FeSCN2+ de couleur rouge
On mesure ensuite l'intensité de la coloration à l'aide d'un spectrophotomètre
en ayant au préalable effectué une gamme d'étalonnage puisque selon Beer-Lambert A = epsilon x l x C (longueur d'onde = 480 nm)
A absorbance
epsilon : coefficient d'extinction moléculaire mol-1.L.cm-1
l longueur de la cuve en cm
C concentration en mol/L
@+
Bonjour,
Je peux répondre à ta question 3/ , car j'ai eu la même en TP. Seulement chez moi les données sont différentes: "en déduire la masse de cristaux qu'il faut dissoudre pr préparer 500 mL d'une solution de concentration massique 100mg/L" (tu n'auras qu'à changer les valeurs ^^).
Voici mon raisonnement:
_2Fe(SO_4)_2,6H_2O)) = 392 g/mol
= 392 g/mol
Donc dans 1 mol il y a 392g de sel de Mohr. Donc dans 1 L il y a 392 g de sel de Mohr.
De plus, dans 1L il y a 55,8g de fer, et dans les 392g de sel de Mohr il y a 55,8g de fer. On peut donc écrire: dans 392g il y a 55,8g de fer, quelle masse devra-t-on prélever pour avoir 100mg de fer?
392 -->55,8g pour 1L
m -->0,1 g pour 1L
m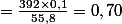 g pour 1 L
g pour 1 L
Donc pour 500mL: m=0,35g.
Pour préparer 500mL de solution il faut donc peser 0,35g de sel de Mohr.
En espérant t'avoir aidé. :++:
Je peux répondre à ta question 3/ , car j'ai eu la même en TP. Seulement chez moi les données sont différentes: "en déduire la masse de cristaux qu'il faut dissoudre pr préparer 500 mL d'une solution de concentration massique 100mg/L" (tu n'auras qu'à changer les valeurs ^^).
Voici mon raisonnement:
Donc dans 1 mol il y a 392g de sel de Mohr. Donc dans 1 L il y a 392 g de sel de Mohr.
De plus, dans 1L il y a 55,8g de fer, et dans les 392g de sel de Mohr il y a 55,8g de fer. On peut donc écrire: dans 392g il y a 55,8g de fer, quelle masse devra-t-on prélever pour avoir 100mg de fer?
392 -->55,8g pour 1L
m -->0,1 g pour 1L
m
Donc pour 500mL: m=0,35g.
Pour préparer 500mL de solution il faut donc peser 0,35g de sel de Mohr.
En espérant t'avoir aidé. :++:
merci bien.....
par contre "lft123", je ne comprend pas à quoi me sert le volume molaire pour déduire la concentration molaire de l'eau oxygénée avec les infos que j'ai... :triste: ... et pusi que signifie "CSTP"? et enfin, est ce que la valeur de Vm est constante (tjs égale à 22,4?? )car je croyais que c'était 24..c'est pour ça...
par contre "lft123", je ne comprend pas à quoi me sert le volume molaire pour déduire la concentration molaire de l'eau oxygénée avec les infos que j'ai... :triste: ... et pusi que signifie "CSTP"? et enfin, est ce que la valeur de Vm est constante (tjs égale à 22,4?? )car je croyais que c'était 24..c'est pour ça...
5 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
