Bonjour à tous!
J'ai une petite question à vous poser : pourquoi,dans une solution saturée de chlorure de sodium, un précipité se forme quand on rajoute un cristal d'AgCl solide?
Merci à ceux qui auront la gentillesse de me répondre
Solution saturée de chlorure de sodium
3 messages
- Page 1 sur 1
Bonjour,
Pour te répondre il faut faire appel à une constante d'équilibre; il s'agit de celle du produit de solubilité que l'on écrit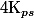 . Elle varie selon le couple cation-anion que l'on considère. L'argent à généralement une faible solubilité dans l'eau et donc ses
. Elle varie selon le couple cation-anion que l'on considère. L'argent à généralement une faible solubilité dans l'eau et donc ses 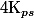 sont souvent petits.
sont souvent petits.
Par contre le sodium est parmi les cations les plus solubles avec le potassium.
Le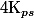 est le produit des solubilités (en mol ou g/L) des espèces en présence à l'équilibre. Pour trouver la solubilité d'un composé il faut donc prendre la racine du
est le produit des solubilités (en mol ou g/L) des espèces en présence à l'équilibre. Pour trouver la solubilité d'un composé il faut donc prendre la racine du 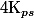 puisqu'il est égal à
puisqu'il est égal à 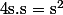 . Pour rappel la solubilité est la concentration maximale d'une espèce au delà de laquelle elle précipité (passe sous forme solide). Le
. Pour rappel la solubilité est la concentration maximale d'une espèce au delà de laquelle elle précipité (passe sous forme solide). Le 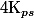 est un nombre sans dimension.
est un nombre sans dimension.
Il faut mettre 360g de sel de cuisine dans 1 L d'eau pour commencer à observer un dépôt de sel solide dans le fond. Dans ce cas pour retrouver le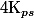 il faut prendre le carré de la solubilité que l'on transforme d'abord en nombre de moles. Soit 360g/L = 6 mol/L; le
il faut prendre le carré de la solubilité que l'on transforme d'abord en nombre de moles. Soit 360g/L = 6 mol/L; le 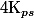 est donc de
est donc de 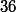 .
.
Par contre pour AgCl le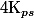 n'est que de
n'est que de 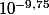 (on trouve ces valeurs dans des tables de chimie).
(on trouve ces valeurs dans des tables de chimie).
Les concentrations nécessaires pour faire précipiter AgCl sont donc infimes comparées à celles de NaCl.
Dans ton exemple si tu veux vérifier que le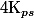 est bien dépassé tu ne dois pas oublier de tenir compte de la concentration en chlore déjà présente ainsi que de la dilution. Mais ici il n'y a pas de dilution vu que tu ajoutes un solide (pas d'ajout d'eau supplémentaire).
est bien dépassé tu ne dois pas oublier de tenir compte de la concentration en chlore déjà présente ainsi que de la dilution. Mais ici il n'y a pas de dilution vu que tu ajoutes un solide (pas d'ajout d'eau supplémentaire).
Exemple: tu as un litre avec 1 mol de NaCl, tu ajoutes 1 mol de AgCl solide dans ta solution. Les cristaux d'AgCl vont se dissocier et passer en solution. La concentration en chlore sera de 2 mol/L et celle en Ag toujours 1M (mol/L). Le produit de solubilité (Q) -hors équilibre- est donc de 2.1 = 2 ce qui dépasse largement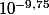 donc il y a précipitation. Dans cet exemple le chlorure d'argent aurait précipité même s'il était dissous dans de l'eau pure (sans saturation de NaCl) puisque un Q = 1 est déjà largement supérieur à
donc il y a précipitation. Dans cet exemple le chlorure d'argent aurait précipité même s'il était dissous dans de l'eau pure (sans saturation de NaCl) puisque un Q = 1 est déjà largement supérieur à 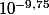
Pour te répondre il faut faire appel à une constante d'équilibre; il s'agit de celle du produit de solubilité que l'on écrit
Par contre le sodium est parmi les cations les plus solubles avec le potassium.
Le
Il faut mettre 360g de sel de cuisine dans 1 L d'eau pour commencer à observer un dépôt de sel solide dans le fond. Dans ce cas pour retrouver le
Par contre pour AgCl le
Les concentrations nécessaires pour faire précipiter AgCl sont donc infimes comparées à celles de NaCl.
Dans ton exemple si tu veux vérifier que le
Exemple: tu as un litre avec 1 mol de NaCl, tu ajoutes 1 mol de AgCl solide dans ta solution. Les cristaux d'AgCl vont se dissocier et passer en solution. La concentration en chlore sera de 2 mol/L et celle en Ag toujours 1M (mol/L). Le produit de solubilité (Q) -hors équilibre- est donc de 2.1 = 2 ce qui dépasse largement
3 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
