Rendement : hydrolyse d'un ester
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
farator
- Membre Irrationnel
- Messages: 1319
- Enregistré le: 16 Déc 2006, 14:03
-
 par farator » 16 Mai 2008, 14:31
par farator » 16 Mai 2008, 14:31
Salut,
petite question :
Comment calculer le rendement de l'hydrolyse d'un ester ?
C'est bien :

(acide)/

(acide) =

(acide)/
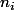
(ester)
Ou encore

(alcool)/

(alcool) =

(alcool)/
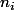
(ester)
?
Merci
-
entropik
- Membre Relatif
- Messages: 395
- Enregistré le: 11 Sep 2006, 14:49
-
 par entropik » 16 Mai 2008, 15:24
par entropik » 16 Mai 2008, 15:24
Euh je crois pas et puis là tu cherches la version compliquée du rendement, à moins que tu ne fasses déjà de la chimie analytique je pense que la version simple te suffira: c'est le rapport entre la masse obtenue au labo et la masse qu'on obtiendrait si la réaction était complète. Sinon je me fierais plutôt à la formule sur wiki: pour un produit j:
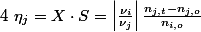
où n est la quantité de matière (moles), et

le coefficient stchiométrique. Les indices o et t représentent respectivement l'état initial et un temps ultérieur donné. L'indice i fait référence au réactif limitant. X le taux de conversion et S la sélectivité
-
farator
- Membre Irrationnel
- Messages: 1319
- Enregistré le: 16 Déc 2006, 14:03
-
 par farator » 16 Mai 2008, 15:35
par farator » 16 Mai 2008, 15:35
J'ai pas tout compris ^^
En tout cas tu es d'accord pour dire que dans le cas d'une estérification, le rendement est égal à :

(ester)/

(ester) =

(ester)/
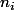
(réactif limitant)
?
J'ai fait le même principe pour trouver le rendement dans le cas d'une hydrolyse d'un ester ...
-
entropik
- Membre Relatif
- Messages: 395
- Enregistré le: 11 Sep 2006, 14:49
-
 par entropik » 16 Mai 2008, 17:02
par entropik » 16 Mai 2008, 17:02
Oui c'est juste, j'avais pas capté au premier abord
-
farator
- Membre Irrationnel
- Messages: 1319
- Enregistré le: 16 Déc 2006, 14:03
-
 par farator » 16 Mai 2008, 17:08
par farator » 16 Mai 2008, 17:08
Ok =)
Merci
-
AL-kashi23
- Membre Rationnel
- Messages: 765
- Enregistré le: 14 Aoû 2007, 10:59
-
 par AL-kashi23 » 16 Mai 2008, 18:46
par AL-kashi23 » 16 Mai 2008, 18:46
Pas forcément juste puisque ça ne marche que si 1 mole d'ester se forme pour 1 mole du réactif limitant consommé..
Par exemple, tu peux avoir une esterification qui mène à la synthèse d'un triester : attention aux nombres stoechiométriques dans ce cas.
-
entropik
- Membre Relatif
- Messages: 395
- Enregistré le: 11 Sep 2006, 14:49
-
 par entropik » 16 Mai 2008, 23:00
par entropik » 16 Mai 2008, 23:00
Oui voilà pourquoi je préfère la formule de wiki mais bon ici j'ai supposé que c'était un cas simple avec des nombre stchiométriques égaux à 1
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités