Reaction acido-basiques 1ere S
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 20 Fév 2007, 15:14
par inesdu01 » 20 Fév 2007, 15:14
Bonjour,
j'aurais besoin d'aide a propos d'un exercice de chimie que j'ai du mal a comprendre (d'ailleur je n'arrive qu'a faire des exercices vraiment simples sur les reaction acido basiques (du style quand on me dis quel est l'acide quel est la base!)
Donc voila l'exercice: Mélanges d'acide et de base
Un médicament préconisé contre les troubles de la digestion contient de l'hydrogenocarbonate de sodium

, du carbonate de sodium

et de l'acide tartrique

(diacide)
1. Faire l'inventaire de tous les couples acide/base présents lorsque l'on dissout ce médicament dans l'eau.
2. Ajuster les nombres stoechiométriques des équations de toutes les réactions possibles lors de la dissolution de ce médicament.
Pour

je trouve
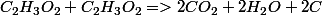
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 21 Fév 2007, 21:57
par inesdu01 » 21 Fév 2007, 21:57
personne ne veux me repondre???
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 21 Fév 2007, 23:24
par anima » 21 Fév 2007, 23:24
inesdu01 a écrit:Bonjour,
j'aurais besoin d'aide a propos d'un exercice de chimie que j'ai du mal a comprendre (d'ailleur je n'arrive qu'a faire des exercices vraiment simples sur les reaction acido basiques (du style quand on me dis quel est l'acide quel est la base!)
Donc voila l'exercice: Mélanges d'acide et de base
Un médicament préconisé contre les troubles de la digestion contient de l'hydrogenocarbonate de sodium

, du carbonate de sodium

et de l'acide tartrique

(diacide)
1. Faire l'inventaire de tous les couples acide/base présents lorsque l'on dissout ce médicament dans l'eau.
2. Ajuster les nombres stoechiométriques des équations de toutes les réactions possibles lors de la dissolution de ce médicament.
Pour

je trouve
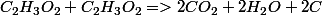
Pourquoi séparer ta molécule en 2 molécules? :hum:
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 22 Fév 2007, 00:15
par inesdu01 » 22 Fév 2007, 00:15
je sais pas disons que je suis plus aussi forte qu'avant en chimie...
J'y comprend presque rien pourtant je bosse... :cry: :briques:
-
pouik
- Membre Rationnel
- Messages: 516
- Enregistré le: 12 Oct 2006, 16:16
-
 par pouik » 22 Fév 2007, 11:51
par pouik » 22 Fév 2007, 11:51
Salut,
Alors tout d'abord ce que tu proposes ci-dessous est complètement faux :
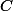
tout seul n'existe pas !! i.e. on ne le voit jamais dans une équation !!
inesdu01 a écrit:Pour

je trouve
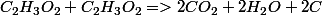
Je vais t'aider pour la 1.
*

peut être
acide ou
base (c'est un amphotère acido-basique). Les couples le mettant en jeu sont :

et

*

est une
base. Le couple le mettant en jeu est :

* On te dit que

est un
diacide, donc mécaniquement tu sais qu'il peut perdre soit un proton
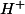
soit deux. Et donc t'as plus qu'à retirer des
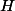
(et à équilibrer avec des charges négatives) pour trouver tes bases conjuguées. Donc ici ça te donne comme couples :

et
 Voilà voilà !!
Voilà voilà !! :zen: :zen:
-
jeps
- Membre Relatif
- Messages: 162
- Enregistré le: 19 Oct 2005, 16:04
-
 par jeps » 22 Fév 2007, 17:47
par jeps » 22 Fév 2007, 17:47
pouik a écrit:Salut,
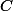
tout seul n'existe pas !! i.e. on ne le voit jamais dans une équation !!
bonjour, juste une ptite remarque en passant. le carbone "tout seul" existe bel et bien! le carbone pur se trouve dans la nature sous deux formes différentes, le graphite (structure hexagonale) et le diamant (structure tétraédrique).
-
pouik
- Membre Rationnel
- Messages: 516
- Enregistré le: 12 Oct 2006, 16:16
-
 par pouik » 22 Fév 2007, 20:08
par pouik » 22 Fév 2007, 20:08
Désolé,
Je croyais que c'était un mythe
jeps a écrit:le carbone pur se trouve dans la nature sous deux formes différentes, le graphite (structure hexagonale) et le diamant (structure tétraédrique).
:ptdr: :ptdr:
Bon aller, Bonne soirée.
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 22 Fév 2007, 21:58
par inesdu01 » 22 Fév 2007, 21:58
pouik a écrit:*

est une
base. Le couple le mettant en jeu est :

* On te dit que

est un
diacide, donc mécaniquement tu sais qu'il peut perdre soit un proton
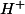
soit deux. Et donc t'as plus qu'à retirer des
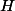
(et à équilibrer avec des charges négatives) pour trouver tes bases conjuguées. Donc ici ça te donne comme couples :

et
 Voilà voilà !!
Voilà voilà !! :zen: :zen:
Comment on peux savoir que telle ou telle formule est une base ou un acide?
J'ai pas compris pour

le raisonnement...
-
pouik
- Membre Rationnel
- Messages: 516
- Enregistré le: 12 Oct 2006, 16:16
-
 par pouik » 23 Fév 2007, 10:18
par pouik » 23 Fév 2007, 10:18
Bonjour,
En fait tu as deux alternatives :
- ou bien elles font parti de ton cours : moi c'était le cas en 1ère, j'avais une feuille avec une quinzaine de couples à
conaitre par coeur dont les deux premiers.
- ou bien là tu sais que ca réagit avec l'eau : et si tu sais si l'eau se transforme en
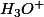
ou en

(c'est aussi un ampholyte acido-basique), t'as plus qu'à écrire l'équation, en connaissant trois sur quatre dans l'équation, il est alors facile de savoir si tu dois rajouter un
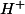
ou en enlever un dans la formule de ton réactif !!
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 23 Fév 2007, 22:38
par inesdu01 » 23 Fév 2007, 22:38
et comment savoir si l'eau se transforme en
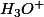
ou en
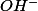
-
inesdu01
- Membre Naturel
- Messages: 54
- Enregistré le: 19 Fév 2007, 17:11
-
 par inesdu01 » 27 Fév 2007, 20:28
par inesdu01 » 27 Fév 2007, 20:28
Bonjour,
Ce qui me donnerais:

et

et

Pourquoi d'abord parler d'amphotere puis ensuite d'ampholyte?
C'est quoi la difference?
Merci!
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
