Bonjour, voici un problème de chimie. J'ai répondu à quelques questions, mais j'aurais besoin d'aide pour me guider. Voici l'énoncé :
Afin de vérifier la notion de famille, on réalise l'expérience suivante avec 3 métaux alcalins : le lithium Li, le sodium Na et le potassium K.
Dans un cristallisoir rempli d'eau, on ajoute 10 gouttes de phénolphtaléine. Cet indicateur coloré, incolore dans l'eau, devient rose en présence d'ions HO- (aq).
Un fragment de métal d'un gramme est placé dans un tube à essais rempli d'eau, retourné dans le cristallisoir.
Pour chaque alcalin testé, la transformation chimique ayant lieu entre le métal alcalin et l'eau produit un gaz incolore,recueilli dans le tube à essais. L'eau devient rose et le métal finit par disparaître.
Pour identifier le gaz, on présente une allumette à l'entrée du tube Dans chaque cas, on entend une détonation.
I.INTERPRETATION DES OBSERVATIONS:
a. Quel est le gaz formé par la réaction ? L'élément chimique que le constitue fait-il partie des alcalins ?
b. Expliquer pourquoi l'eau devient rose.
c. Quels sont les ions monoatomiques formés par le lithium, le sodium et le potasium ? Justifier la réponse.
d. Comment peut-on expliquer la disparition du métal ?
II.PROPRIETES DES FAMILLES :
a. Si on répétait la même expérience avec du rubidium (Rb : Z = 37) ou du fer (Fe : Z = 26), observerait-on le même résultat ? Justifier la réponse.
b.La combustion du sodium dans le dioxygène conduit à la formation d'un composé ionique : l'oxyde de sodium. Quelle est la formule de ce composé ?
c. Donner le nom et la formule des composés que l'on obtiendrait avec le lithium et le potassium.
d. Les alcalins réagissent aussi à chaud avec les gaz halogènes dichlore et dibrome. Donner les formules brutes des gaz halogènes et les formules des composés qu'ils forment en réagissant avec les alcalins étudiés. Sont-ils ioniques ou moléculaires ?
Réponses :
I.c)Pour le lithium : Li+ ( car il respecte la règle du duet)
Pour le sodium : Na+ ( règle de l'octet)
Pour le potassium : K+ (règle de l'octet)
II.b) Formule de l'oxyde de sodium : 2Na2O
c) Lithium: oxyde de lithium : 2Li2O
Potassium : oyde de potassium: 2K2O
d) Cl2 + 2Li = 2LiCl
Cl2 + 2Na = 2NaCl
Cl2 + 2K = 2KCl
Br2 + 2Li = 2LiBr
Br2 + 2Na = 2NaBr
Br2 + 2K = 2KBr
Quelqu'un peut-il m'aider à faire le reste et vérifier mes réponses svp ?
Merci d'avance pour votre aide.
Problème de chimie
7 messages
- Page 1 sur 1
Alcalins
Les trois métaux alcalins que tu examines réagissent vilemment avec l'eau en formant de l'hydroxyde du métal d'une part et du gaz hydrogène H2 d'autre part. L'hydroxyde de métal se dissout dans l'eau. La réaction est, avec le lithium :
2 Li + 2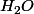 --> 2 LiOH +
--> 2 LiOH + 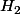
Avec Na, et K, c'est pareil, avec les mêmes coefficients. Il se produit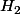 , en plus de NaOH ou KOH
, en plus de NaOH ou KOH
L'élément H n'est pas considéré comme un alcalin, malgré qu'il soit dans la même colonne que Li, Na et K.
Rb ferait la même réaction, mais pas Fe !
Ceci dit, les molécules LiOH, NaOH et KOH formées sont reconnaissables en solution en ce qu'elles forment des ions OH-. Or les ions OH- réagissent avec la phénolphtaléine en produisant une coloration rose.
2 Li + 2
Avec Na, et K, c'est pareil, avec les mêmes coefficients. Il se produit
L'élément H n'est pas considéré comme un alcalin, malgré qu'il soit dans la même colonne que Li, Na et K.
Rb ferait la même réaction, mais pas Fe !
Ceci dit, les molécules LiOH, NaOH et KOH formées sont reconnaissables en solution en ce qu'elles forment des ions OH-. Or les ions OH- réagissent avec la phénolphtaléine en produisant une coloration rose.
Peut-être qu'avec un langage imagé, tu comprendras mieux.
Quand Na voit une molécule d'eau, cet atome veut absolument se lier à l'atome d'oxygène O que l'eau contient. Mais pour cela, il faut chasser un atome H qui y est lié. Qu'à cela ne tienne. Na coupe une liaison H-O, éjecte un H et prend sa place. La molécule d'eau est alors transformée en NaOH. Mais le H éjecté a une obsession : il ne veut pas rester seul. Il cherche un 2ème atome H qui provient d'une réaction semblable dans le voisinage. Et il forme avec lui une molécule H2.
Résumons. Il a fallu que 2 atomes Na attaquent chacun une molécule d'eau, pour libérer chacun un H, ce qui fait en fin de compte 2 NaOH et une molécule H2.
Cela s'écrit en style télégraphique : 2 Na + 2 H2O --> 2 NaOH + H2
Quand Na voit une molécule d'eau, cet atome veut absolument se lier à l'atome d'oxygène O que l'eau contient. Mais pour cela, il faut chasser un atome H qui y est lié. Qu'à cela ne tienne. Na coupe une liaison H-O, éjecte un H et prend sa place. La molécule d'eau est alors transformée en NaOH. Mais le H éjecté a une obsession : il ne veut pas rester seul. Il cherche un 2ème atome H qui provient d'une réaction semblable dans le voisinage. Et il forme avec lui une molécule H2.
Résumons. Il a fallu que 2 atomes Na attaquent chacun une molécule d'eau, pour libérer chacun un H, ce qui fait en fin de compte 2 NaOH et une molécule H2.
Cela s'écrit en style télégraphique : 2 Na + 2 H2O --> 2 NaOH + H2
Bonjour. D'accord. Maintenant les questions qui me posent le plus de problème sont la b, la c et la d du II.
Pour la b et la c, j'ai changé et j'ai mis :
Li+O2=Li2O ce qui donne oxyde de lithium
K+O2= K2O ce qui donne oxyde de potassium
Na+O2=Na2O ce qui donne oxyde de sodium
Et pour la d, je vous propose:
Dibrome=Br2
Dichlore=Cl2
Formules composés : 2 LiCl, 2 LiBr, 2 KCl, 2 KBr, 2 NaCl, 2 NaBr
Est-ce que mes réponses sont justes ?
Merci
Pour la b et la c, j'ai changé et j'ai mis :
Li+O2=Li2O ce qui donne oxyde de lithium
K+O2= K2O ce qui donne oxyde de potassium
Na+O2=Na2O ce qui donne oxyde de sodium
Et pour la d, je vous propose:
Dibrome=Br2
Dichlore=Cl2
Formules composés : 2 LiCl, 2 LiBr, 2 KCl, 2 KBr, 2 NaCl, 2 NaBr
Est-ce que mes réponses sont justes ?
Merci
7 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
