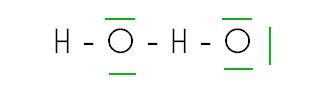J'ai plusieurs exercices en chimie qui portent sur la représentation d'une molécule selon Lewis. Je dois écrire les représentations de Lewis avec les DL en rouge et les DNL en vert des molécules données. (voir à la fin)
A partir du cours, je n'arrive pas à réaliser les différentes molécules sur ma feuille ; & encore moins préciser les doublets liants en rouge & les doublets non liants en vert.
Je compte sur vous pour m'aider :ptdr:
H2 O2
HOCl
HCN
J'ai ensuite une questions où je dois écrire les formules développées des isomères des molécules :
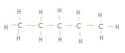
C5H12
C2H6O
J'ai réussi la première, mais la 2e ... :S
Voici la 1ere ce que j'ai obtenu :
Ensuite j'ai un exercice où je dois dire si les molécules sont isomères ou non.
Molécule A :
CH3 - CH2 - CH - CH3
|
CH3
Molécule B :
CH3
|
CH3 - CH - CH2 - CH3
Molécule C :
CH3 - CH - CH2 - CH3
|
CH3
Molécule D :
CH3
|
CH2 - CH - CH3
|
CH3
Je n'ai pas compris donc je compte sur vous pour m'expliquer ; parce qu'avec ce que j'ai compris j'aurais dit oui pour tous mais après réflexion y a quelque chose qui cloche :S
Merci d'avance !