TS : exercice évolution spontanée d'une pile
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
sou71
- Membre Relatif
- Messages: 430
- Enregistré le: 05 Nov 2008, 17:51
-
 par sou71 » 06 Mar 2009, 16:50
par sou71 » 06 Mar 2009, 16:50
Bonjour, j'ai exercice à faire pour lundi, et j'ai jamais été très fort en chimie, j'aurais besoin d'aide, merci.
Voilà l'énoncé :
 I Sens d'évolution spontanée de la pile
I Sens d'évolution spontanée de la pile1.
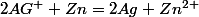
2. Qr,i =
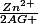
3.a. Qr,i =
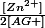
=
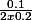
= 0.25
Le quotient de réaction initial Qr,i est inférieur à la constante d'équilibre K, l'évolution est dans le sens direct.
b.
???4. a.
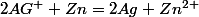
b. pôle + :

pôle - :
 II Pile en fonctionnement
II Pile en fonctionnement1. Signe positif,
je sais pas comment justifier2.a) U= E + rI
b) U= E + rI 0 = 1.5 + r x 1.5 r= -1 ohm
III Quantité d'électricité1. a) ...
-
sou71
- Membre Relatif
- Messages: 430
- Enregistré le: 05 Nov 2008, 17:51
-
 par sou71 » 06 Mar 2009, 20:08
par sou71 » 06 Mar 2009, 20:08
personne pour m'aider ?
-
maurice
- Membre Rationnel
- Messages: 848
- Enregistré le: 27 Juin 2006, 19:40
-
 par maurice » 06 Mar 2009, 21:44
par maurice » 06 Mar 2009, 21:44
On n'arrive pas à lire ton texte: trop petit ! Mais, à lire les réponses que tu donnes on devine qu'il s'agit de la pile Zn-Ag, basée sur les demi-équatikons suivantes :
Zn --> Zn2+ + 2 e-
Ag+ + e- --> Ag
dont la réaction somme est :
Zn + 2 Ag+ --> 2Ag + Zn2+
Le pôle négatif est le zinc, car c'est lui qui fournit les électrons. Ce zinc est aussi l'anode, car le zinc s'oxyde, et en chimie l'oxydation se produit toujours à l'anode.
Le pôle positif est l'argent, car c'est lui qui attire les électrons, qui vont servir à neutraliser les ions Ag+ qui s'y trouvent. Cet argent est aussi la cathode, car l'argent se réduit, et en chimie la réduction se fait toujours à la cathode.
On peut aussi se souvenir que le zinc est le pôle négatif de la pile car son potentiel redox est négatif (-0.76 V). Alors que l'argent est le pôle positif, vu que son potentiel redox est positif (+0.80 V)
-
sou71
- Membre Relatif
- Messages: 430
- Enregistré le: 05 Nov 2008, 17:51
-
 par sou71 » 06 Mar 2009, 21:48
par sou71 » 06 Mar 2009, 21:48
merci pour ces informations
-
sou71
- Membre Relatif
- Messages: 430
- Enregistré le: 05 Nov 2008, 17:51
-
 par sou71 » 07 Mar 2009, 10:22
par sou71 » 07 Mar 2009, 10:22
maurice a écrit:On n'arrive pas à lire ton texte: trop petit !
Vous pouvez cliquez-dessus pour afficher dans un format en plus grand.
-
Hurykhan
- Membre Naturel
- Messages: 32
- Enregistré le: 08 Mai 2008, 10:23
-
 par Hurykhan » 07 Mar 2009, 17:07
par Hurykhan » 07 Mar 2009, 17:07
Pour l'ampèremètre, il est branché en série.
Donc, s'il est dans le sens de I ( intensité ) le signe de la valeur qu'il va te donner sera positif.
S'il est dans le sens contraire de I, la valeur sera négative.
Pour trouver le sens de I:
Dessine ta pile.
Place ta cathode & ton anode.
Tu sais qu'à l'anonde il se produit une oxydation, donc, une libération d'électrons. De là, tu sais d'où partent les électrons dans le fil, et par convention I est dans le sens inverse de tes électrons.
Comprends tu?
Ainsi, tu peux placer I, puis ton ampèremètre. I va du pôle + vers le pôle - dans le fil. Comme la cathode correspond au pôle + tu peux déterminer sur quels pôles tu branches ton ampèremètre, et donc le signe de la valeur de I.
Si mes expliquations ne sont pas assez claires, excuse moi !
-
Hurykhan
- Membre Naturel
- Messages: 32
- Enregistré le: 08 Mai 2008, 10:23
-
 par Hurykhan » 07 Mar 2009, 17:09
par Hurykhan » 07 Mar 2009, 17:09
III
Le tableau d'avancement.
Plus haut, tu as la réaction.
Tu la réécris dans la première ligne de ton tableau. Tu calcule ensuite les quantités de matière pour chaque élément, puis tu fais un bilan molaire. Une fois ceci fait, rappelle moi!!
-
sou71
- Membre Relatif
- Messages: 430
- Enregistré le: 05 Nov 2008, 17:51
-
 par sou71 » 07 Mar 2009, 18:36
par sou71 » 07 Mar 2009, 18:36
Merci, voila le schéma :

donc I positif
-
maurice
- Membre Rationnel
- Messages: 848
- Enregistré le: 27 Juin 2006, 19:40
-
 par maurice » 08 Mar 2009, 17:20
par maurice » 08 Mar 2009, 17:20
Avançons.
Dans la pile en fonctionnement en court-circuit, tu mesures un courant de I = 20 mA, donc 0.02 A. Mais la tension nominale E reste 1.5 V.
Donc la résistance interne r est de : E/r = (1.5 V)/(0.02 A) = 75 ohm.
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités


