Bonjour tout le monde!
Je vous fais part de mon énoncé:
Dans 20 mL d'une solution décimolaire de chlorure de baryum,BaCl2,on ajoute 30 mL d'eau. Calculer les valeurs des molarités des ions Ba2+ et Cl- avant et après addition d'eau. Vérifier l'électroneutralité de la solution.
Le problème est que je ne trouve pas les valeurs des molarités des ions,
parcontre j'arrive à vérifier l'électroneutralité. C'est sûrement très bête mais mon résultat ne colle pas avec celui de mon bouquin :ptdr:
merci d'avance
électroneutralité des solutions aqueuses
10 messages
- Page 1 sur 1
...j'enfile ma cape...
La solution de 20 ml est décimolaire, donc le nombre de moles est de 20*10^-3*10^-2
On rajoute 30ml d'eau donc le nombre de mole de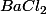 ne varie pas, ainsi :
ne varie pas, ainsi :
C=2*10^-4/50*10^-3 = 4*10^-3mol.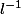 =
= 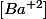
il y a deux fois plus de chlore que de barium donc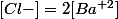 .
.
Normalement là tu dois pouvoir t'en sortir.
On rajoute 30ml d'eau donc le nombre de mole de
C=2*10^-4/50*10^-3 = 4*10^-3mol.
il y a deux fois plus de chlore que de barium donc
Normalement là tu dois pouvoir t'en sortir.
résultat différent
dès le début de ta démonstration je trouve un résultat différent :doh:
La solution de 20 ml est décimolaire donc on a :
N (bacl2) = 0.1 * 20.10^-3 soit 2.10^-3
ensuite comme tu l'as dit, l'eau ne fait pas varier les molarités des ions Ba^2+ et Cl^- donc avant comme après dilution les molarités sont les mêmes
Pour déduire les molarités tu reprends l'équation bilan?
Ba^2+ + 2Cl^- => Bacl2 Et après? :cry:
Merci d'avance pour ton aide (précieuse) :++:
La solution de 20 ml est décimolaire donc on a :
N (bacl2) = 0.1 * 20.10^-3 soit 2.10^-3
ensuite comme tu l'as dit, l'eau ne fait pas varier les molarités des ions Ba^2+ et Cl^- donc avant comme après dilution les molarités sont les mêmes
Pour déduire les molarités tu reprends l'équation bilan?
Ba^2+ + 2Cl^- => Bacl2 Et après? :cry:
Merci d'avance pour ton aide (précieuse) :++:
....Et je dirais même plus.......
effectivement, petite gaffe de l'odre de 0,1. pour C.
le résultat exact est donc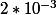 pour
pour 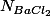 , ce qui fait
, ce qui fait 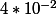 pour C.
pour C.
J'emploie bien l'équation de dissolution de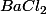 pour déduire les molarités. Sachant que selon cette équation
pour déduire les molarités. Sachant que selon cette équation
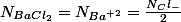
le résultat exact est donc
J'emploie bien l'équation de dissolution de
une dernière question pour le plaisir
Merci Triderou pour ton aide, j'ai finalement le bon résultat et j'ai compris la méthode, mais il reste une dernière chose: lorsqu'on demande "les valeurs des molarités" je comprend par là, le nombre de mol, soit N.
Mais les quelques corrigés que j'ai sous la main répondent à ces question par des concentrations.
Comment comprendre ces questions? (après je te lâche :) ) :zen:
Mais les quelques corrigés que j'ai sous la main répondent à ces question par des concentrations.
Comment comprendre ces questions? (après je te lâche :) ) :zen:
electroneutralite
bonjour,
au sujet d'electroneutralité,
j'ai un petit probleme mais diferent
je ne sais coment faire pour trouver cette fameuse reaction de electroneutralité
par example : Hcl + H2O---------) H3O+ + CL-
LA reponse etait [H3O+ ] = [OH- ] + [CL- ].
je ne sais coment m'y prendre, ni la methode pour trouver de facon generale
de trouver lequation d'electroneutralite
merci de tout coeur..
au sujet d'electroneutralité,
j'ai un petit probleme mais diferent
je ne sais coment faire pour trouver cette fameuse reaction de electroneutralité
par example : Hcl + H2O---------) H3O+ + CL-
LA reponse etait [H3O+ ] = [OH- ] + [CL- ].
je ne sais coment m'y prendre, ni la methode pour trouver de facon generale
de trouver lequation d'electroneutralite
merci de tout coeur..
C'est simple toute solution aqueuse est électriquement neutre càd que les cations équilibrent les anions.
La somme des "+" est égale à la somme des "-".
Pour les réactions acido-basiques tu as :
l'autoprotolyse de l'eau : 2 H2O --> H3O+ + OH-
et la dissociation de l'acide ou de la base : AH --> A- + H3O+
BOH --> B+ + OH-
@+
La somme des "+" est égale à la somme des "-".
Pour les réactions acido-basiques tu as :
l'autoprotolyse de l'eau : 2 H2O --> H3O+ + OH-
et la dissociation de l'acide ou de la base : AH --> A- + H3O+
BOH --> B+ + OH-
@+
10 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
