Bonsoir,
Déjà si on te donne la quantité de
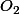
à consommer il n'y a plus besoin de faire l'exercice...
Ensuite, quelle est la formule de l'acétylène ? Donc quelle est sa masse molaire (tu dois connaître
a priori celles de
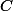
,
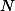
,
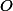
et
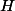
j'imagine) ? On te donne la masse d'acétylène à consommer, donc tu as accès à sa quantité de matière.
Puis, écris l'équation de la réaction de l'acétylène avec
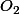
et fais un tableau d'avancement en notant par exemple
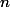
la quantité de
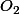
que tu cherches. Je te laisse la suite...
Ben314 a écrit:(*) En général, arrivé à ce point là, le chimiste de base (qui est souvent une bille en math et n'aime pas les lettres) prend a=2 de façon a avoir des entier (premiers entre eux) b=5, c=2 , d=4. Mais ça a pas franchement d'utilité particulière.
Prendre
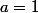
ou
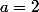
ou autre change tout

Supposons par exemple que l'on veuille calculer l'énergie dégagée par la réaction de combustion d'une mole de
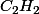
. Là il faut obligatoirement équilibrer l'équation avec
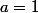
(sinon on se retrouve avec le double d'énergie). À moins de faire attention et de diviser ensuite par la valeur choisie pour

...
