C'est vrai que je n'avais pas vu ces accolades. J'essaie avec.
Je tape Fe^{3+} entre 2 balises TEX. Cela donne :
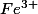
Je tape H_{2}O entre deux balises TEX. Cela donne :

OK. Cela marche.
Voyons un cas plus compliqué, comme le ion sulfate, où il y a des indices et des exposants..
Je tape SO_{4}^{2-} entre 2 balises TEX. Cela donne :

Cela marche bien. Fantastique !
Merci de l'information !
J'essaie de recopier mon texte précédent, mais avec les bonnes balises. Cela donne :
Le ion [Fe(CN)

] chargé 3- ou 4-, a une stabilité telle que la concentration en ion cyanure CN- est donnée par :
K = [Fe

]


/
_{6}^{y-}])
= 10

ou 10

.
où x = +2 ou +3.
Dans tous les cas, on tire :
[CN-] = 6

Et si la concentration du ion Fe(CN)

vaut 0.01, on tire :
K = (1/6)(

)

=

=

ou

.
On tire la concentration du ion cyanure, qui vaut

dans un cas, et

dans l'autre
La première de ces valeurs dépasse la limite tolérable. Pas la deuxième. Le Fe(CN)6^3- est bien moins toxique que l'autre. Donc si on veut faire disparaître les ions CN- d'une solution, il faut ajouter du fer ferrique Fe(III) et non du fer ferreux Fe(II).
J'espère que tu as suivi d'abord, et compris ensuite.
C'était un peu laborieux.
Merci encore.
