TP Chimie - Dosages et pH-métriques
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
Blenno
- Membre Naturel
- Messages: 73
- Enregistré le: 17 Oct 2007, 12:45
-
 par Blenno » 21 Nov 2008, 19:37
par Blenno » 21 Nov 2008, 19:37
Bonsoir, j'ai mon TP à finir (les questions), mais j'ai un léger doute sur la réaction. On verse à l'équivalence de l'acide chlorhydrique, dans un bécher contenant une solution d'hydroxyde de sodium.
1/ La réaction support du osage est une réaction acido-basique. Ecrire les couples mis en jeu dans la transformation et les demi-équations correspondantes.
J'ai mis:
} / H_2O_{(l)})
}=H_2O_{(l)}+H^+_{(aq)})
} / HO^-{(aq)})
}=HO^-{(aq)}+H^+_{(aq)})
2/En déduire l'équation de la réaction support du dosage.
}+H_2O_{(l)}+NaOH_{(s)}=Cl^-_{(aq)}+Na^+_{(aq)}+HO^-_{(aq)}+H_3O^+_{(aq)})
Est-ce la bonne équation ? Si besoin je scanne le sujet du TP (c'est titanesque, donc le réécrire :s). Car j'ai un doute, merci d'avance.
Et bonne soirée.

-
acoustica
- Membre Irrationnel
- Messages: 1043
- Enregistré le: 08 Juil 2008, 10:00
-
 par acoustica » 21 Nov 2008, 20:05
par acoustica » 21 Nov 2008, 20:05
Déjà, n'écris pas les ions spectateurs (qui n'interviennent pas dans la réaction, c'est-à-dire Cl- et Na+).
Comme c'est pas la peine de bloquer des heures sur une queston qui n'est sûrement pas la partie principale de l'exo, je te donne la réponse:
C'est HO- + H30+ = 2 H2O. Le H3O+ vient de l'acide chlorhydrique (te casse pas la tête avec les histoire de "je met H+ ou H3O+?" C'est pareil)
Retiens bien ça, tu retrouvera très souvent cette équation. :++:
-
Blenno
- Membre Naturel
- Messages: 73
- Enregistré le: 17 Oct 2007, 12:45
-
 par Blenno » 21 Nov 2008, 20:25
par Blenno » 21 Nov 2008, 20:25
Ca c'est la réaction d'autoprotolyse de l'eau, j'ai mis toutes les espèces car 2 questions plus tard, on me demande d'exprimer
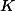
en fonction de

.
Edit: Mais dans le cas présent,

=
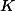
.
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 3 invités
