Bonjour, dans un post précédent je vous faisez part de mes problème à faire mon DM de chimie car j'étais absente lors des deux cours qu'a durait ceux qu'ils ont fait en cours. J'ai donc pris l'initiative de faire des exos avant pour comprendre et ensuite je ferais mon devoir.J'espère que vous pourriez m'aider à résoudre mes problème.
Exercice 1:
Un artificier veut préparer un feu de Bengale rouge. Il mélange 122,6 g de chlorate de potassium (KClO3), de 16,0 g de souffre (S) et 18,0 g de carbone (C).
L'équation chimique modélisant la transformation est la suivante:
2(KClo3) +S+3C___________K(2)S + 3(CO2)+ Cl2
1/ Calculer les quantités de matière de chacun des réactifs.
2/ Montrer que le mélange est stoechiométrique.
3/ Calculer les quantités de matières des produits formées.
4/ Calculer le volume total occupé par les gazs produits.
5/ Pourquoi ne faut-il pas réaliser cette réaction dans un récipient hermétiquement clos.
Mes réponses sont:
1/ M(2KClO3)=245,2 g/mol
n= m/M
122,6/245,2= 0,5 mol
M(S)=32,1 g/mol
16,0/32,1= 7,58*10^-1 mol
M(K2S)=36,0 g/mol
18,0/36,0= 5*10-1 mol
2/ Pour la deux je ne sais pas mais je pense qu'on doit suivre le modèle suivant:
n(Cu)=n(OH)/2
3/Alors, là je ne sais pas.J'avais l'intention d'appliquer la même formule ( n=m/M) mais j'ai pas la masse de chaque produits formés. Alors j'espère que vous pourriez m'aidez en me donnant la formule qu'on doit utiliser pour que je puisse faire cette question.
J'espère que vous pourriez m'apporter votre aide. Je vous remerci d'avance. Au revoir est passer une bonne journée. :marteau:
Bilan de matière, niveau seconde
7 messages
- Page 1 sur 1
Bonjour S@m, le tableau d'avancement je viens de le découvrir. Justement je fais des exos pour voir comment ça marche. Mais on m'a parlé d'un tableau d'évolution. Ce qui à éveillé ma curiosité. J'aimerai bien savoir ce qu'est c'est, quelles différences il y a entre un tableau d'avancement et celui-là. :id:
DOnc:
Question 1:
Pour le KClO3 on est d'accord, y'a bien 0.5 mol au départ.
Par contre pour le souffre tu as du faire une erreur de calcul, 16/32 ca fait 0.5 mol pas 7,58*10^-1 mol, Pour le C c'est aussi 0.5.
QUestion 2:
Je sais pas pourquoi tu me parles de Cu et de OH lol, mais disons que oui c 'est une méthode à appliquer généralement, reactif1/coeff = reactif2/ coeff, enfin il faut verifier cette relation. La ton mélange est stoechiometrique, tout simplement parcque tu as la même quantité de matiere pour tes trois réactifs ( 0.5 mol) [tu as deja pris en compte les coefficients en fait]
Calculons sans les prendre en compte:
KClO3 : M=122.5 g/mol, m=122.6, donc n= 1 mol
S=> pas de probleme puisque coeff = à 1, on trouve bien 0.5 dans tous les cas
C:M=12, m= 18, donc n=1.5 mol
Verifions que le mélange est bien stoechiometrique, on a
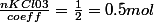
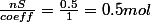
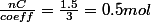
=> Mélange stoéchiometrique car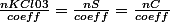
La valeur finale trouvé (0.5 mol) est ta valeur du xmax, avancement final de ta réaction
Question 3
Dans un mélange stoechiometrique, puisque tu as la même quantité de matiere pour les trois réactifs, ceux ci vont tous les trois etre consommés entierement ( tu n'as donc pas de reactif limitant). Et dans ce cas, la valeur du x max , c'est à dire l'avancement final, la quantité de produit maximal formé au cours de la reaction, sera égal à ta quantité de matiere de départ des réactifs, soit ici 0.5 mol (multiplié par le coefficient stoechiometrique de tes produits)
Calculons la quantité de matiere formée:
K(2)S: coefficient stoechiometrique égal à 1, donc quantité de matiere égal à xmax, soit 0.5 mol
3(CO2): coefficient sto égal à 3, donc quantité de matiere égal à 3 xmax soit 3*0.5= 1.5 mol
Cl2: coefficient stoechiometrique égal à 1, donc quantité de matiere égal à xmax, soit 0.5 mol
Question 4 :
Tu ne peux pas appliquer la formule n=m/M pour un gaz! Il faut utiliser V= Vm (volume molaire d'un gaz, normalment dans ton bouquin) \times n, avec n ta quantité de matiere.
Tu appliques ca d'une part pour K2S, puis pour Co2, puis pour Cl2, et tu sommes les trois volumes trouvés, puisqu'on te demande le total :++:
Question5
A ton avis?
Bon courage :id:
PS: exemple de tableau d'avancement que tu aurais pu faire:

Question 1:
Pour le KClO3 on est d'accord, y'a bien 0.5 mol au départ.
Par contre pour le souffre tu as du faire une erreur de calcul, 16/32 ca fait 0.5 mol pas 7,58*10^-1 mol, Pour le C c'est aussi 0.5.
QUestion 2:
Je sais pas pourquoi tu me parles de Cu et de OH lol, mais disons que oui c 'est une méthode à appliquer généralement, reactif1/coeff = reactif2/ coeff, enfin il faut verifier cette relation. La ton mélange est stoechiometrique, tout simplement parcque tu as la même quantité de matiere pour tes trois réactifs ( 0.5 mol) [tu as deja pris en compte les coefficients en fait]
Calculons sans les prendre en compte:
KClO3 : M=122.5 g/mol, m=122.6, donc n= 1 mol
S=> pas de probleme puisque coeff = à 1, on trouve bien 0.5 dans tous les cas
C:M=12, m= 18, donc n=1.5 mol
Verifions que le mélange est bien stoechiometrique, on a
=> Mélange stoéchiometrique car
La valeur finale trouvé (0.5 mol) est ta valeur du xmax, avancement final de ta réaction
Question 3
Dans un mélange stoechiometrique, puisque tu as la même quantité de matiere pour les trois réactifs, ceux ci vont tous les trois etre consommés entierement ( tu n'as donc pas de reactif limitant). Et dans ce cas, la valeur du x max , c'est à dire l'avancement final, la quantité de produit maximal formé au cours de la reaction, sera égal à ta quantité de matiere de départ des réactifs, soit ici 0.5 mol (multiplié par le coefficient stoechiometrique de tes produits)
Calculons la quantité de matiere formée:
K(2)S: coefficient stoechiometrique égal à 1, donc quantité de matiere égal à xmax, soit 0.5 mol
3(CO2): coefficient sto égal à 3, donc quantité de matiere égal à 3 xmax soit 3*0.5= 1.5 mol
Cl2: coefficient stoechiometrique égal à 1, donc quantité de matiere égal à xmax, soit 0.5 mol
Question 4 :
Tu ne peux pas appliquer la formule n=m/M pour un gaz! Il faut utiliser V= Vm (volume molaire d'un gaz, normalment dans ton bouquin) \times n, avec n ta quantité de matiere.
Tu appliques ca d'une part pour K2S, puis pour Co2, puis pour Cl2, et tu sommes les trois volumes trouvés, puisqu'on te demande le total :++:
Question5
A ton avis?
Bon courage :id:
PS: exemple de tableau d'avancement que tu aurais pu faire:

7 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
