bonjour ; est qu'il y a qq pour me corriger ces exercices svp :
on met dans un bassin d'eau a temperature +7°c un de masse 1KG et de temperature +77°c.
1) calculer l'entropie de se bout de metal .
2)calculer l'entropie de l'eau.
3)calculer l'entropie total . conclure.
solution:
1) (delta S)= integral de T0=+77°c----->T1=+7°c
de (m*cp* dt)/T.
2)(delta S)= M * CP*(T0+T1) / T1 ( parceque l'eau reçoit de la chaleur a partir du bout de metal )
es ce que c'est juste svp .
j'ai un petit problème dans cet execice ; est ce que vs pouvez m'aider:
on a 2 moles de gaz parfait qui se compresse de l'état initiale (PA ,VA ,TA ) à l'état final (PB =3PA , VB, TB =TA).
1er) trajet :(A1B): est une transformation a T= cst.
2eme)trajet :(A2B):est une transformation droite.
3eme)trajet :(A3B):est une transformation à V=cst puit une transformation à P= cst.
on ns demande de calculer le travail (W) et la quantité de chaleur (Q) qui s'échange entre le système et le milieu exterieur pour chaque trajet .
on ns donne :TA =300°K ; R= 25/3 (S.I)
ce que je n'arrive pas à calculer c'est la quantité de chaleur (Q) pour 2eme)trajet et le 3eme)trajet .veuillez m'aider svp. merci. :cry:
Thermodynamique
9 messages
- Page 1 sur 1
Bonjour
Ce post aurait plus sa place dans la section physique, la thermo n'est pas de la chimie
La 1ère question a l'air juste :
Soit T0 = 77°c = 350 K et T1 = 7°C = 280 K

Pour la question 2, on peut dire que Qeau=-Qmétal car le système est isolé (Qtotal=0) donc
}{T_{eau}})
"2eme)trajet A2B):est une transformation droite."
A2B):est une transformation droite."
Si tu as réussi à calculer W (avec l'aire sous la courbe), tu peux utiliser le premier principe : donc
donc 
Ce post aurait plus sa place dans la section physique, la thermo n'est pas de la chimie
La 1ère question a l'air juste :
Soit T0 = 77°c = 350 K et T1 = 7°C = 280 K
Pour la question 2, on peut dire que Qeau=-Qmétal car le système est isolé (Qtotal=0) donc
"2eme)trajet
Si tu as réussi à calculer W (avec l'aire sous la courbe), tu peux utiliser le premier principe :
rebonjour ;merci de m'avoir répondu "Sdec25" ; mais je voulais vs dire que pour ("2eme)trajet :(A2B):est une transformation droite." ) dans cet exercice on ns pas donnez ni Cv ni Cp c'est pour cela que je block.
est ce que vs me corrige ce dernier :
on ns demande de calculer l'entropie de 1mole de vapeur d'eau à 200°C a partir de l'entropie d'eau liquide à 298°K sachant que l'enthalpie de vaporisation à 100°C ( Lv = 2240 J/g) ; S° à 298°K ( H2OL) =70 J/K° mol ; Cp ( H2OL) = 4,2J/K° g .
solution :
j'ai fait le shéma suivant:
S = ???
H2O (LIQUIDE) à 298°K ----------------------> H2O (VAPEUR)à 200°C
+ +
+ +
+ +
+ +
H2O (LIQUIDE) à 100°C ----------------------> H2O (VAPEUR) à 100°C
mais ici je block ;je ne sais pas comment faire les calcules????
merci a vous. :doh:
est ce que vs me corrige ce dernier :
on ns demande de calculer l'entropie de 1mole de vapeur d'eau à 200°C a partir de l'entropie d'eau liquide à 298°K sachant que l'enthalpie de vaporisation à 100°C ( Lv = 2240 J/g) ; S° à 298°K ( H2OL) =70 J/K° mol ; Cp ( H2OL) = 4,2J/K° g .
solution :
j'ai fait le shéma suivant:
S = ???
H2O (LIQUIDE) à 298°K ----------------------> H2O (VAPEUR)à 200°C
+ +
+ +
+ +
+ +
H2O (LIQUIDE) à 100°C ----------------------> H2O (VAPEUR) à 100°C
mais ici je block ;je ne sais pas comment faire les calcules????
merci a vous. :doh:
pas de problème.
W = -intégrale (P.dV) = Aire sous la courbe (de A à B) dans le diagramme P,V
donc on calcule l'aire du trapèze : W = (VA-VB) x (PA+PB) / 2
Pour la transformation 3 on calcule l'aire du rectangle.
Et comme Tf=Ti, deltaT=0 donc Q=-W
Je vais regarder le deuxième exercice.
sylvie a écrit:rebonjour ;merci de m'avoir répondu "Sdec25" ; mais je voulais vs dire que pour ("2eme)trajetA2B):est une transformation droite." ) dans cet exercice on ns pas donnez ni Cv ni Cp c'est pour cela que je block.
W = -intégrale (P.dV) = Aire sous la courbe (de A à B) dans le diagramme P,V
donc on calcule l'aire du trapèze : W = (VA-VB) x (PA+PB) / 2
Pour la transformation 3 on calcule l'aire du rectangle.
Et comme Tf=Ti, deltaT=0 donc Q=-W
Je vais regarder le deuxième exercice.
Alors pour le 2ème exercice :
H2O(l) à 298 K ----> H2O(l) à 100°C ----> H2O(g) à 100°C ----> H2O(g) à 200°c
J'appellerai les états A, B, C et D et les transformations 1, 2 et 3

Jusque là rien de bien compliqué.
Ensuite il faut calculer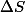 pour chaque transformation.
pour chaque transformation.
1ère transformation : échauffement à pression constante

2ème : changement d'état
 car T est constante pendant le changement d'état et Q = +n.Lv pour transformer l'eau
car T est constante pendant le changement d'état et Q = +n.Lv pour transformer l'eau
3ème : Si la transformation est à pression constante : et si elle est à volume constant :
et si elle est à volume constant :  .
.
Ensuite on calcule l'intégrale
Voilà, on devrait pouvoir calculer la variation d'entropie maintenant.
H2O(l) à 298 K ----> H2O(l) à 100°C ----> H2O(g) à 100°C ----> H2O(g) à 200°c
J'appellerai les états A, B, C et D et les transformations 1, 2 et 3
Jusque là rien de bien compliqué.
Ensuite il faut calculer
1ère transformation : échauffement à pression constante
2ème : changement d'état
3ème : Si la transformation est à pression constante :
Ensuite on calcule l'intégrale
Voilà, on devrait pouvoir calculer la variation d'entropie maintenant.
salut; pour le 2°) exercice : vs n'avez pas utiliser : S° à 298°K ( H2OL) =70 J/K° mol . pourquoi?
et dans l'exo on ns a pas donner Cp ou Cv de H2O vapeur .
et je voulais vs dire qu'il ns ont demandé de calculer l'entropie ; est ce que c'est la meme chose si on ns demande de calculer la variation d'entropie c'est a dire est ce que (calculer l'entropie = calculer la variation d'entropie ) ; car moi le shema que j'ai fait sa concerne surtout ( calculer la variation d'entropie ) et eux il ns on demander (calculer l'entropie) et on plus ils ns ont donne S° à 298°K ( H2OL) =70 J/K° mol c'est pour cela que ma solution et la votre me pose un probleme ???? et c'est a vs de voir si j'ai juste.
merci de me repondre. :++:
et dans l'exo on ns a pas donner Cp ou Cv de H2O vapeur .
et je voulais vs dire qu'il ns ont demandé de calculer l'entropie ; est ce que c'est la meme chose si on ns demande de calculer la variation d'entropie c'est a dire est ce que (calculer l'entropie = calculer la variation d'entropie ) ; car moi le shema que j'ai fait sa concerne surtout ( calculer la variation d'entropie ) et eux il ns on demander (calculer l'entropie) et on plus ils ns ont donne S° à 298°K ( H2OL) =70 J/K° mol c'est pour cela que ma solution et la votre me pose un probleme ???? et c'est a vs de voir si j'ai juste.
merci de me repondre. :++:
En fait j'ai calculé la variation d'entropie  à partir de laquelle on peut retouver l'entropie finale.
à partir de laquelle on peut retouver l'entropie finale.
Ce qu'on cherche c'est S(D) donc avec S(A)=70 J/(K.mol)
avec S(A)=70 J/(K.mol)
Ni Cp ni Cv n'est donné, mais est-ce que gamma est donné ?
Et connaît-on le type de la dernière transformation ? Car l'entropie varie avec plusieurs facteurs dont la pression.
Ce qu'on cherche c'est S(D) donc
Ni Cp ni Cv n'est donné, mais est-ce que gamma est donné ?
Et connaît-on le type de la dernière transformation ? Car l'entropie varie avec plusieurs facteurs dont la pression.
l'exercice c'est ce que j'ai écrie :
on ns demande de calculer l'entropie de 1mole de vapeur d'eau à 200°C a partir de l'entropie d'eau liquide à 298°K sachant que l'enthalpie de vaporisation à 100°C ( Lv = 2240 J/g) ; S° à 298°K ( H2OL) =70 J/K° mol ; Cp ( H2OL) = 4,2J/K° g .
il ns l'on donné de la sorte. merci.
on ns demande de calculer l'entropie de 1mole de vapeur d'eau à 200°C a partir de l'entropie d'eau liquide à 298°K sachant que l'enthalpie de vaporisation à 100°C ( Lv = 2240 J/g) ; S° à 298°K ( H2OL) =70 J/K° mol ; Cp ( H2OL) = 4,2J/K° g .
il ns l'on donné de la sorte. merci.
On peut peut-être considérer que la transformation 3 est adiabatique réversible, dans ce cas  mais normalement on ne peut pas admettre cela.
mais normalement on ne peut pas admettre cela.
Pour pouvoir calculer la variation d'entropie d'un gaz il faut normalement connaître au moins 2 paramètres parmi température, pression et volume.
Il est demandé de calculer l'entropie d'une mole d'eau à 200°C mais l'entropie dépend aussi de la pression donc on ne peut pas la calculer, il faudrait connaître la dernière transformation.
Pour pouvoir calculer la variation d'entropie d'un gaz il faut normalement connaître au moins 2 paramètres parmi température, pression et volume.
Il est demandé de calculer l'entropie d'une mole d'eau à 200°C mais l'entropie dépend aussi de la pression donc on ne peut pas la calculer, il faudrait connaître la dernière transformation.
9 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 2 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
