Constante d'acidité
Peut-on mélanger l'huile et l'eau ? Posez vos questions de chimie ici
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 19 Déc 2006, 19:47
par theluckyluke » 19 Déc 2006, 19:47
Salut tout le monde,
en fait, j'aimerai savoir la différence dans l'expression entre la constante d'acidité

d'un couple acide/base et la constante d'équilibre

.
Ensuite, j'ai juste un souci sur cet exo pour la question 2 :
volume sanguin après effort (6pts)
L'acide lactique est un acide de formule CH3-CHOH-COOH, noté AH.
1. Ecrire la réaction de cet acide avec l'eau. Donner l'expression de sa constante d'acidité.
Lors d'un effort musculaire violent , l'organisme produit de l'acide lactique. On estime qu'un individu peut produire 7 10-4 mol par litre de sang. Cet acide réagit entre autre avec le couple (CO2,H2O) / HCO3- qui va réguler cet apport d'acide lactique. Le sang normal contient par litre de sang 2,73 10-2 mol d'ion HCO3- et 1,4 10-3 mol de CO2 dissous.
2. Calculer le pH du sang normal.
3. Ecrire l'équation de la réaction entre l'acide lactique et l'ion hydrogénocarbonate ; en déduire la constante de cet équilibre de cette réaction.
4. Le dioxyde de carbone formé lors de cette réaction, est éliminé par la respiration par exemple, au fur et à mesure de sa production. En utilisant les critères d'évolution de Le chatelier, expliquer pourquoi cette réaction peut être considérée comme totale.
5. Dans le cas où la réaction entre l'acide lactique et l'ion hydrogénocarbonate est totale, calculer le pH du sang immédiatement après l'effort.
6. Calculer les concentrations de toutes les espèces chimiques juste après l'effort.
pKa du couple acide lactique / ion lactate : pKa1 = 3,6 à 37°C
pKa du couple (CO2,H2O) / HCO3- pKa2 = 6,1 à 37°C
dans le corrigé, il se servent de la formule

mais pourquoi en écrivant l'équation

et en remarquant que

donc que que le pH vaut
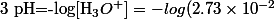 = 1.56)
on aboutisse pas au bon résultat?
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 19 Déc 2006, 20:03
par anima » 19 Déc 2006, 20:03
theluckyluke a écrit:Salut tout le monde,
en fait, j'aimerai savoir la différence dans l'expression entre la constante d'acidité

d'un couple acide/base et la constante d'équilibre

.
Ensuite, j'ai juste un souci sur cet exo pour la question 2 :
volume sanguin après effort (6pts)
L'acide lactique est un acide de formule CH3-CHOH-COOH, noté AH.
1. Ecrire la réaction de cet acide avec l'eau. Donner l'expression de sa constante d'acidité.
Lors d'un effort musculaire violent , l'organisme produit de l'acide lactique. On estime qu'un individu peut produire 7 10-4 mol par litre de sang. Cet acide réagit entre autre avec le couple (CO2,H2O) / HCO3- qui va réguler cet apport d'acide lactique. Le sang normal contient par litre de sang 2,73 10-2 mol d'ion HCO3- et 1,4 10-3 mol de CO2 dissous.
2. Calculer le pH du sang normal.
3. Ecrire l'équation de la réaction entre l'acide lactique et l'ion hydrogénocarbonate ; en déduire la constante de cet équilibre de cette réaction.
4. Le dioxyde de carbone formé lors de cette réaction, est éliminé par la respiration par exemple, au fur et à mesure de sa production. En utilisant les critères d'évolution de Le chatelier, expliquer pourquoi cette réaction peut être considérée comme totale.
5. Dans le cas où la réaction entre l'acide lactique et l'ion hydrogénocarbonate est totale, calculer le pH du sang immédiatement après l'effort.
6. Calculer les concentrations de toutes les espèces chimiques juste après l'effort.
pKa du couple acide lactique / ion lactate : pKa1 = 3,6 à 37°C
pKa du couple (CO2,H2O) / HCO3- pKa2 = 6,1 à 37°C
dans le corrigé, il se servent de la formule

mais pourquoi en écrivant l'équation

et en remarquant que

donc que que le pH vaut
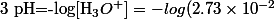 = 1.56)
on aboutisse pas au bon résultat?
Depuis quand l'acide en question est un acide fort? Dès lors, ton 10^-pH tombe à l'eau

-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 19 Déc 2006, 20:18
par theluckyluke » 19 Déc 2006, 20:18
euh, je comprend pas vraiment ce que tu veux dire parce que dans le programme depuis quelques années, on ne parle plus d' "acide fort".
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 19 Déc 2006, 20:25
par anima » 19 Déc 2006, 20:25
theluckyluke a écrit:euh, je comprend pas vraiment ce que tu veux dire parce que dans le programme depuis quelques années, on ne parle plus d' "acide fort".

est une relation ne marchant que pour les acides forts. Or, ton "sang" est (culture générale) solution tampon. Il ne peut donc pas être fort.
La formule pour acide faible:
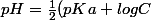)
si je me souviens bien (je sais plus si c'est +log ou -log)
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 19 Déc 2006, 20:27
par theluckyluke » 19 Déc 2006, 20:27
anima a écrit:
est une relation ne marchant que pour les acides forts. Or, ton "sang" est (culture générale) solution tampon. Il ne peut donc pas être fort.
La formule pour acide faible:
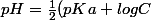)
si je me souviens bien (je sais plus si c'est +log ou -log)
mouais, le seul truc, c'est que je sais pas ce que veut dire "acide fort" ou faible...
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 19 Déc 2006, 20:31
par anima » 19 Déc 2006, 20:31
theluckyluke a écrit:mouais, le seul truc, c'est que je sais pas ce que veut dire "acide fort" ou faible...
Fort: totalement dissocié
Faible: partiellement dissocié
De plus, quand on te donne un COUPLE, c'est implicitement (sauf piège)
FAIBLE (j'suis fatigué moi :++: ), pour la simple raison que Na+/NaOH....Ah oui. quand une base ou un acide est fort...son espèce conjuguée est inerte :we:
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 19 Déc 2006, 20:32
par theluckyluke » 19 Déc 2006, 20:32
anima a écrit:Fort: totalement dissocié
Faible: partiellement dissocié
De plus, quand on te donne un COUPLE, c'est implicitement (sauf piège) fort, pour la simple raison que Na+/NaOH....Ah oui. quand une base ou un acide est fort...son espèce conjuguée est inerte :we:
bon ok. je vais essayer de voir.
merci beaucoup.
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 19 Déc 2006, 20:36
par anima » 19 Déc 2006, 20:36
theluckyluke a écrit:bon ok. je vais essayer de voir.
merci beaucoup.
Relis mon post. J'ai changé un mot, qui change tout le sens :we:
-
maurice
- Membre Rationnel
- Messages: 848
- Enregistré le: 27 Juin 2006, 19:40
-
 par maurice » 19 Déc 2006, 22:17
par maurice » 19 Déc 2006, 22:17
Anima s'excite beaucoup, semble-t-il.
Mais il a tort.
Il se trompe. Il te donne des informations incorrectes.
Il dit par exemple que la relation pH = 10^-pH n'est vraie que pour les acides forts. C'EST FAUX !
C'est la relation elle-même qui est fausse. Le pH n'est JAMAIS égal à 10^-pH.
x n'est jamais égal à 10^-x.
Ce qui est correct, c'est de dire que [H+] = 10^-pH
(Désolé, je ne sais pas taper les exposants avec mon clavier !)
Mais cette relation est toujours juste, avec les acides forts, comme avec les acides faibles, n'en déplaise à Anima, qui devrait revoir sa copie !!
Au départ, tu aimerais écrire [H+] = [HCO3^-], et calculer le pH d'après cette relation. Ton idée est bonne, mais ce calcul ne s'applique qu'au cas où on dissout CO2 dans de l'eau pure. Or, dans le sang il y a aussi d'autres acides, forts ou faibles peu importe. Donc cette formule ne s'applique pas !
-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 20 Déc 2006, 09:14
par anima » 20 Déc 2006, 09:14
maurice a écrit:Anima s'excite beaucoup, semble-t-il.
Mais il a tort.
Il se trompe. Il te donne des informations incorrectes.
Il dit par exemple que la relation pH = 10^-pH n'est vraie que pour les acides forts. C'EST FAUX !
C'est la relation elle-même qui est fausse. Le pH n'est JAMAIS égal à 10^-pH.
x n'est jamais égal à 10^-x.
Ce qui est correct, c'est de dire que [H+] = 10^-pH
(Désolé, je ne sais pas taper les exposants avec mon clavier !)
Mais cette relation est toujours juste, avec les acides forts, comme avec les acides faibles, n'en déplaise à Anima, qui devrait revoir sa copie !!
Au départ, tu aimerais écrire [H+] = [HCO3^-], et calculer le pH d'après cette relation. Ton idée est bonne, mais ce calcul ne s'applique qu'au cas où on dissout CO2 dans de l'eau pure. Or, dans le sang il y a aussi d'autres acides, forts ou faibles peu importe. Donc cette formule ne s'applique pas !
Dis donc...Tu vas me dire que mon prof a faux, peut-être? Depuis quand le pH de 2 acides faibles de constante d'acidité différente sera le même?

n'est valable que pour les acides forts, je persiste et je signe. Autrement, on aurait de l'acide éthanoique et acide chlorhydrique de même pH à même concentration. Or, à 10^-2mol/L, l'acide éthanoique: pH~~4.7; acide chlorhydrique: pH=2
C'est qui qui a tort?
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 20 Déc 2006, 13:52
par theluckyluke » 20 Déc 2006, 13:52
anima a écrit:C'est qui qui a tort?
c'est moi. ce que j'ai fait était faux lol
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 20 Déc 2006, 13:53
par theluckyluke » 20 Déc 2006, 13:53
sinon je confirme, j'avais pas vu, mais c'est bien

et

-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 21 Déc 2006, 09:14
par anima » 21 Déc 2006, 09:14
theluckyluke a écrit:sinon je confirme, j'avais pas vu, mais c'est bien

et

Bah oui. Ca ne s'appelle pas pH pour rien. en chimie, p -log :we:
-
theluckyluke
- Membre Relatif
- Messages: 371
- Enregistré le: 01 Mai 2006, 10:13
-
 par theluckyluke » 21 Déc 2006, 19:09
par theluckyluke » 21 Déc 2006, 19:09
anima a écrit:Bah oui. Ca ne s'appelle pas pH pour rien. en chimie, p -log :we:
ah ouais!!! ok!!!! merci, je savais pas, c'est vrai que c'est plus logique en effet!
-
quantum
- Membre Naturel
- Messages: 13
- Enregistré le: 24 Déc 2006, 11:58
-
 par quantum » 24 Déc 2006, 19:28
par quantum » 24 Déc 2006, 19:28
ok jai esseyer de bien présenté la reponse a la 1ere quetion pour l'exarcice peut etre demain je vai le faire

-
anima
- Membre Transcendant
- Messages: 3762
- Enregistré le: 15 Sep 2006, 11:00
-
 par anima » 24 Déc 2006, 19:43
par anima » 24 Déc 2006, 19:43
quantum a écrit:ok jai esseyer de bien présenté la reponse a la 1ere quetion pour l'exarcice peut etre demain je vai le faire

Je la connaissais pas, la démonstration de Ka. Tu m'évite bien de l'apprentissage... :zen:
-
quantum
- Membre Naturel
- Messages: 13
- Enregistré le: 24 Déc 2006, 11:58
-
 par quantum » 25 Déc 2006, 14:41
par quantum » 25 Déc 2006, 14:41

Salut je vois que vous narriver pas a vous mettre daccord sur la notion de pH
Cest quoi le pH ??
Un peu dhistorique :
Les chimiste ont remarqué limportance de la concentration des ions H+ Vue leurs influence majeur dans les réactions chimiques .
On a voulu bien quantifier la [H+] ,il est clair alors de calculer cette concentration.
Mais vue que cette concentration est très faible (lordre des 10-14 même)
Il est clair de chercher une fonction mathématique qui amplifie ces valeurs très petite.
Le choix de la fonction logarithmique en faite est fait pour dautre raisons.
Donc par definition : log est un logarithme décimale
pH= -log([H+]) donc 10^-pH=[H+]
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités

