Bonjour!
Ouf.. je suis vraiment partout :ptdr:
Alors.. on a besoin du question 2 (precedente) pour comprendre ma question.
2. On dissout un comprime dans l'eau jusqu'a obtenir 50,0 ml d'une solution aqueuse homogene. Calculer la concentration molaire C en aspirine apportee dans la solution preparee.
J'ai fait:
la quantite de matiere * Na
qui donne: 3,05*10^-3 * 6,02*10^23 = 1,84 * 10^21 molecules
Maintenant, c'est ici ou l'exercice me perd:
3. Une autre formulation existe sous la denomination " aspirine 320 " dans laquelle un comprime ne contient plus que 320 mg d'aspirine.
a. Calculer la concentration molaire Cf en aspirine apportee dans 100 ml d'une solution aqueuse obetenue par la dissolution complete d'un comprime d' "aspirine 320".
Montrer que le volume V de la solution de concentration molaire C (preparee en 2 ) qu'il faut prelever pour obtenir par dilution, 100 ml de la solution precedente est egal a 32,0 ml.
Finalement, je peux poser ma question. Ou est le rapport entre la question 2 et la question 3? Je ne comprend pas ce qu'on me demande.
Merci!
Concentration molaire
7 messages
- Page 1 sur 1
...j'enfile ma cape...
Je ne suis pas d'accord avec la solution que tu apportes à la question 2, Est-ce que la masse molaire d'aspirine ( ou sa formule brute) et la masse exacte d'aspirine dans le comprimé (question 2) sont données dans l'énoncé de l'exercice ?
Non. Il a fallut que je les trouve.
Alors, La formule brute de l'aspririne est: C9H8O5
Avec un masse moleculaire de
M(H)*8+M(C)*9=M(O)*3
1,00*8+12,0*9+16,0*3= 164 g.mol-1
Apres j'ai fait:
n = m/M qui donne:
nC9H8O3 = mC9H8O3/MC9H8O3= 0,5/164 + 3,05 * 10^-3 mol
puisque l'enonce indique qu'il y a 500mg d'asprine dans un comprime.
Puis la quantite de matiere: * Na
qui donne: 3,05*10^-3 * 6,02*10^23 = 1,84 * 10^21 molecules.
Oops, je vois ce que j'ai fait. J'ai, par accident, donne la mauvaise reponse. Alors la vraie pour 2. est:
CC9H8O3 = nC9H8O3/V = 3,05*10^-3/ 50,0*10^-3 = 6,1 * 10^-2 mol.L-1
Je me bloque toujours sur la question 3.
Alors, La formule brute de l'aspririne est: C9H8O5
Avec un masse moleculaire de
M(H)*8+M(C)*9=M(O)*3
1,00*8+12,0*9+16,0*3= 164 g.mol-1
Apres j'ai fait:
n = m/M qui donne:
nC9H8O3 = mC9H8O3/MC9H8O3= 0,5/164 + 3,05 * 10^-3 mol
puisque l'enonce indique qu'il y a 500mg d'asprine dans un comprime.
Puis la quantite de matiere: * Na
qui donne: 3,05*10^-3 * 6,02*10^23 = 1,84 * 10^21 molecules.
Oops, je vois ce que j'ai fait. J'ai, par accident, donne la mauvaise reponse. Alors la vraie pour 2. est:
CC9H8O3 = nC9H8O3/V = 3,05*10^-3/ 50,0*10^-3 = 6,1 * 10^-2 mol.L-1
Je me bloque toujours sur la question 3.
...j'enfile ma cape...
Normalement ce n'est pas à toi de les chercher ailleurs. Quelles sont les données fournies dans l'exercice?
donnees
Triderou a écrit:Normalement ce n'est pas à toi de les chercher ailleurs. Quelles sont les données fournies dans l'exercice?
Les donnees sont:
*un photo d'asprine a peu pres comme ca:
H
|
H -C - C - C - O - H
| ||
H - C C H
\\ / \ |
C O - C - C - H
| || ||
H O H
et les masses molaires atomiques
M (H) = 1,00 g.mol-1
M (C) = 12,0 g.mol-1
M (O) = 16,0 g.mol-1
Constante d'Avogadro : NA = 6,02,10^23 mol-1
L'autre information etait les reponses de la premiere question que j'ai du trouver.
...j'enfile ma cape...
Pour la 3.a tu fais pareil que dans la 2, ce qui donne:
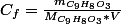
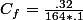
Pour la suite, la question peut être lue comme: trouver le volume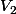 de la solution 2 à prélever tel que par dilution, on obtienne 100ml d'une solution de même concentration que la solution de la question 3.
de la solution 2 à prélever tel que par dilution, on obtienne 100ml d'une solution de même concentration que la solution de la question 3.
Donc la solution de 100ml obtenue après dilution aura pour concentration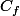
on aura donc: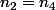 ,
, 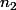 la quantité de matière prélevée et
la quantité de matière prélevée et 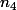 la quantité de matière obtenue après dilution
la quantité de matière obtenue après dilution
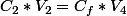
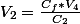
Je te laisse faire le calcul sachant que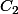 est la concentration trouvée à la question 2 et
est la concentration trouvée à la question 2 et 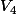 est égal à 100ml
est égal à 100ml
Pour la suite, la question peut être lue comme: trouver le volume
Donc la solution de 100ml obtenue après dilution aura pour concentration
on aura donc:
Je te laisse faire le calcul sachant que
7 messages
- Page 1 sur 1
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :
