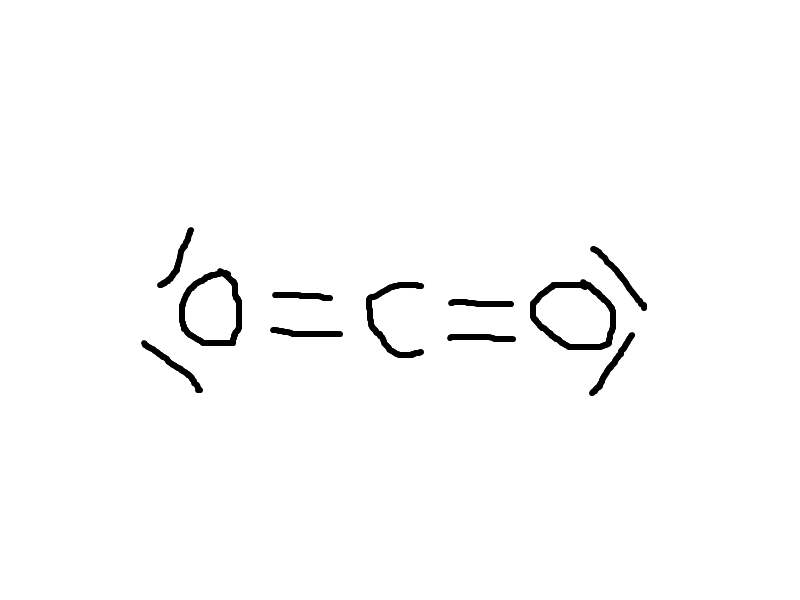Doublet liant , doublet non liant
29 messages
- Page 1 sur 2 - 1, 2
doublet liant , doublet non liant
bonjour a tous
est ce que quelqu'un peut m'expliquer les doublet liant ou les doublet non liant car je ne comprend rien !! :cry:
est ce que quelqu'un peut m'expliquer les doublet liant ou les doublet non liant car je ne comprend rien !! :cry:
pauline62 a écrit:bonjour a tous
est ce que quelqu'un peut m'expliquer les doublet liant ou les doublet non liant car je ne comprend rien !!
Bonsoir,
on peut imaginer un doublet liant un lien entre deux electrons de deux atomes différents et doublet non liant un lien entre deux electrons du même atome.
En regardant sur internet je vois qu'on ai énormement pleins à ne pas comprendre comment trouver les doublets liants/non liants, y compris moi, ça me sort par la tête.
On va essayer de comprendre avec un exemple :
Prenons le Dihydrogène, ça formule est H2 donc il contient 2 atomes H.
L'atome H, sa formule électronique est (K)1 puisque Z=1 (on nous le donne).
On a bien dit que H2 contient 2 atomes H, il y a donc 1*2 soit 2 élections sur la couche externe.
Ensuite vient l'histoire des doublets et je n'ai rien compris... donc j'attends aussi une réponse ^^
On va essayer de comprendre avec un exemple :
Prenons le Dihydrogène, ça formule est H2 donc il contient 2 atomes H.
L'atome H, sa formule électronique est (K)1 puisque Z=1 (on nous le donne).
On a bien dit que H2 contient 2 atomes H, il y a donc 1*2 soit 2 élections sur la couche externe.
Ensuite vient l'histoire des doublets et je n'ai rien compris... donc j'attends aussi une réponse ^^
Bon ,
imagine:
tu écris la lettre "N", tu as 5 electrons sur la derniere couche, alors tu prends ton stylos et tu fais 5 points autour de N.
Un en haut, un à droite,un en bas , un à gauche et un en haut juste à côté du premier que tu as placé.
Alors les deux points proches sont un doublets non liant que tu représentes par un trait. :zen:
imagine:
tu écris la lettre "N", tu as 5 electrons sur la derniere couche, alors tu prends ton stylos et tu fais 5 points autour de N.
Un en haut, un à droite,un en bas , un à gauche et un en haut juste à côté du premier que tu as placé.
Alors les deux points proches sont un doublets non liant que tu représentes par un trait. :zen:
le_fabien a écrit:Ce n'est pas au hasard:
le carbone C doit avoir 4 liaisons externes
L'oxygène O doit en avoir 2
et H une seul
Avec ces données tu peux trouver ta formule de Lewis.
Et comment tu le trouves ça ? Peut tu m'écrire ce que tu fais (commenté si possible) ? ça fait deux semaines que je cherche (quelques heures chaque soirs depuis 15 jours) et je ne m'aitrise toujours pas > j'ai le contrôle bientôt.
Ce serait vraiment sympat de ta part
le_fabien a écrit:Bon ,
imagine:
tu écris la lettre "N", tu as 5 electrons sur la derniere couche, alors tu prends ton stylos et tu fais 5 points autour de N.
Un en haut, un à droite,un en bas , un à gauche et un en haut juste à côté du premier que tu as placé.
Alors les deux points proches sont un doublets non liant que tu représentes par un trait. :zen:
As tu compris ce que j'ai écrit là ?
Ok donc deux points : un trait pour une liaison. Merci 
J'essaie pour le diazote (j'essaie de tout faire) :
Diazote = 2N = N2
N : Z=7
(k)2(L)5
donc 5 électrons sur couche externe
N2=5*2=10 électrons sur couche externe
Nombre de doublet 10/2 = 5
Nombre de doublet liant : ?
Nombre de doublet non liant : ?
7électrons = 3 groupes de 2électrons (6) + 1électron célibataire
= 3 doublets non liant+ 1électron
= 6 doublets non liant+ 1doublet liant
Correct ?
J'essaie pour le diazote (j'essaie de tout faire) :
Diazote = 2N = N2
N : Z=7
(k)2(L)5
donc 5 électrons sur couche externe
N2=5*2=10 électrons sur couche externe
Nombre de doublet 10/2 = 5
Nombre de doublet liant : ?
Nombre de doublet non liant : ?
7électrons = 3 groupes de 2électrons (6) + 1électron célibataire
= 3 doublets non liant+ 1électron
= 6 doublets non liant+ 1doublet liant
Correct ?
29 messages
- Page 1 sur 2 - 1, 2
Qui est en ligne
Utilisateurs parcourant ce forum : Aucun utilisateur enregistré et 4 invités
Tu pars déja ?
Fais toi aider gratuitement sur Maths-forum !
Créé un compte en 1 minute et pose ta question dans le forum ;-)
Identification
Pas encore inscrit ?
Ou identifiez-vous :